
| A. | 海水有“元素故乡”之称,溴被称为“海洋元素” | |
| B. | 发展氯碱工业是利用海水的一大方向,其中氯气是氧化产物,H2是还原产物 | |
| C. | 工业上从海水中获取NaCl和AlCl3,通过电解其熔融盐可获得金属Na和Al | |
| D. | 利用海水通过物理变化可以获得淡水和食盐,但从海水中获取MgCl2和Br2必须通过化学变化 |
分析 A、海水占地球总水量的94%,大海中不仅有取之不尽、用之不竭的水,还溶解了大量的气体物质和各种盐类,人类在陆地上发现的100多种化学元素,在海水中可以找到80多种,人们生活必不可少的食盐及钾、镁、溴、碘、锂、铀、重水等多种重要化学元素,都大量蕴藏于海洋之中,所以海水又被称作化学元素的故乡,地球上99%以上的溴都蕴藏在汪洋大海中,故溴有“海洋元素”的美称.
B、电解饱和氯化钠溶液,氯元素化合价-1价变化为0价,氢元素化合价+1价变化为0价;
C、AlCl3是共价化合物,熔融不能产生阴阳离子;
D、海水中镁元素是以镁离子存在,溴元素以溴离子形式存在,从海水中获取MgCl2需要沉淀后溶解得到,Br2必须通过氧化剂氧化溴离子为溴单质;
解答 解:A、人类在陆地上发现的100多种化学元素,在海水中可以找到80多种,人们生活必不可少的食盐及钾、镁、溴、碘、锂、铀、重水等多种重要化学元素,都大量蕴藏于海洋之中,所以海水又被称作化学元素的故乡,地球上99%以上的溴都蕴藏在汪洋大海中,故溴有“海洋元素”的美称,故A正确;
B、电解饱和氯化钠溶液,氯元素化合价-1价变化为0价,氯元素被氧化得到氯气,氯气是氧化产物,氢元素化合价+1价变化为0价,氢元素被还原,得到氢气为还原产物,故B正确;
C、AlCl3是共价化合物,熔融不能产生阴阳离子,不能得到金属铝,应电解熔融氧化铝得到,电解NaCl其熔融盐可获得金属Na,故C错误;
D、海水中镁元素是以镁离子存在,溴元素以溴离子形式存在,从海水中获取MgCl2需要沉淀后溶解得到,Br2必须通过氧化剂氧化溴离子为溴单质,从海水中获取MgCl2和Br2必须通过化学变化,故D正确;
故选C.
点评 本题考查了海水资源极其综合应用,工业制备物质的原理分析判断,注意物质提取的应用,掌握基础是关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 周期表中位置靠近的元素性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
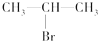 (主要产物),1mol某芳香烃A充分燃烧后可以得到8molCO2和4molH2O.该烃A在不同条件下能发生如下所示的一系列变化.
(主要产物),1mol某芳香烃A充分燃烧后可以得到8molCO2和4molH2O.该烃A在不同条件下能发生如下所示的一系列变化.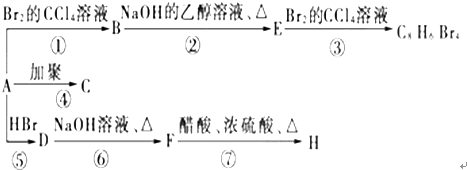
 ②的反应类型:消去反应
②的反应类型:消去反应 +CH3COOH$→_{△}^{浓H_{2}SO_{4}}$
+CH3COOH$→_{△}^{浓H_{2}SO_{4}}$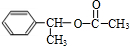 +H2O,反应类型:酯化(取代)反应
+H2O,反应类型:酯化(取代)反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2[PtCl2(OH)4]具有很强的碱性 | B. | 3种含铂化合物的配位数均为6 | ||
| C. | 3种含铂化合物都属于共价化合物 | D. | 3种含铂配合物中Pt的化合价不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | 苯酚钠溶液与少量二氧化碳反应:2C6H5O-+CO2+H2O→2 C6H5OH+CO32- | |
| C. | 在碳酸氢钠溶液中加入过量的氢氧化钡溶液:Ba2++OH-+HCO3-═BaCO3↓+H2O | |
| D. | 用氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O(沸水)═Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L氯气溶于水转移电子数为NA | |
| B. | 1L 0.1mol/L的硫酸铁溶液中含有铁离子的数目为0.2NA | |
| C. | 向氨气合成塔中通入amolN2和3amolH2的混合气,充分反应后生成N-H数为6aNA | |
| D. | 电解硫酸铜溶液时,当阳极产生22.4L(标况)气体,体系中转移电子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H、N、O三种元素形成的化合物中一定含有共价键 | |
| B. | 正戊烷、异丁烷和丙烷属于同系物,沸点依次升高 | |
| C. | 葡萄糖能发生银镜反应,蔗糖、麦芽糖也能发生银镜反应 | |
| D. | 用KSCN溶液检验Fe3+的实验现象是产生血红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
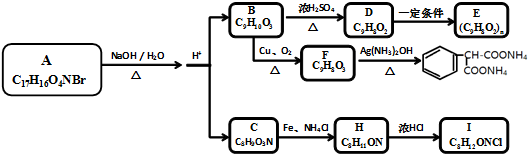
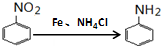
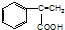 ,C→H的反应类型是还原反应.
,C→H的反应类型是还原反应.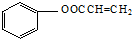 ,
,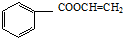 .
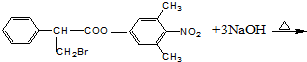
.
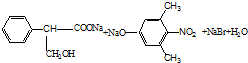 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
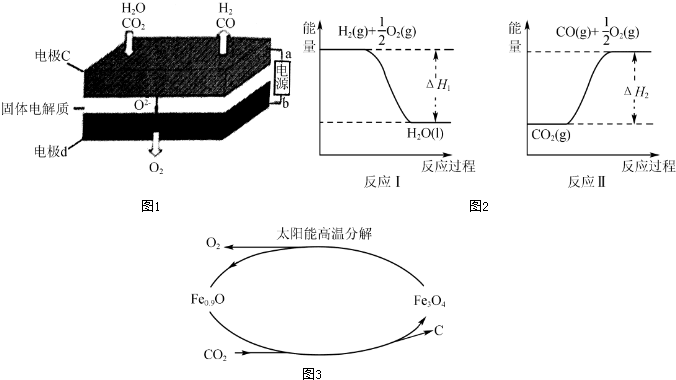
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com