
| A. | 在蒸馏水中滴加浓H2SO4,KW不变 | |
| B. | AgCl沉淀易转化成AgI沉淀且Ksp(AgX)═c(Ag+)•c(X-),故Ksp(AgI)>K(AgCl) | |
| C. | 在Na2S稀溶液中,c(Na+)═2c(S2-)+2c(H2S)+2c(HS-) | |
| D. | 将pH=10的氨水稀释后,溶液中所有离子的浓度均降低 |
分析 A.水的离子积常数只与温度有关,温度升高,水的离子积常数增大;
B.溶解度越小,越容易生成沉淀,其溶度积越小;
C.根据硫化钠溶液中的物料守恒判断;
D.稀释后溶液中氢氧根离子浓度减小,而水的离子积不变,所以氢离子浓度增大.
解答 解:A.水的电离是吸热反应,升高温度促进水电离,浓硫酸在水中稀释放出热量,所以水的离子积常数变大,故A错误;
B.AgCl沉淀易转化成AgI沉淀,说明碘化银更难溶,其溶解度小于氯化银,则其溶度积小于氯化银,则Ksp(AgI)<Ksp(AgCl),故B错误;
C.根据Na2S溶液中的物料守恒可得:c(Na+)═2c(S2-)+2c(H2S)+2c(HS-),故C正确;
D.将pH=10的氨水稀释后,溶液中氢氧根离子浓度减小,由于水的离子积不变,则溶液中氢离子浓度增大,故D错误;
故选C.
点评 本题考查弱电解质的电离、离子浓度大小比较、难溶物溶度积的应用等知识,题目难度中等,根据水电离特点、难溶电解质的溶解平衡原理、物料守恒来分析解答即可.


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:填空题
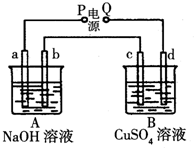 按如图装置实验,A、B两烧杯分别盛放200g 10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).a、b、c为石墨电极,d为铜电极.
按如图装置实验,A、B两烧杯分别盛放200g 10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).a、b、c为石墨电极,d为铜电极.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属晶体能导电,所以离子晶体也能导电 | |
| B. | 六方最密堆积和面心立方最密堆积中由于配位数都是12,所以所得晶胞的形式相同 | |
| C. | 金属晶体中金属原子的堆积模式有4种 | |
| D. | 金属晶体的电子气理论不能解释金属的延展性,但可以解释金属的导电性和熔点高低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸可以使某些气体干燥是利用了它的脱水性 | |
| B. | 王水是浓盐酸和浓硝酸按体积比1:3配成的混合物,可以溶解Au、Pt | |
| C. | 氨气被催化氧化成一氧化氮是氮的固定 | |
| D. | 新制备的氯水中存在三种分子、四种离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在托盘天平上放两片大小相同的纸,然后将氢氧化钠放在纸上称取 | |
| B. | 把称得的氢氧化钠放入盛有适量蒸馏水的烧杯中,溶解、冷却,把溶液转入容量瓶 | |
| C. | 用蒸馏水洗涤烧杯、玻棒2~3次,洗涤液也移入容量瓶 | |
| D. | 沿着玻棒往容量瓶中加蒸馏水,接近刻度时,改用胶头滴管滴加直至溶液凹液面的最低点与刻线相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1 mol SO2的总能量大于1 mol S和1 mol O2能量总和 | |
| B. | 1 mol SO2的总能量小于1 mol S和1 mol O2能量总和 | |
| C. | S(s)+O2(g)=SO2(g)△H=-b kJ•mol-1,b小于a | |
| D. | S(s)+O2(g)=SO2(g)△H=-b kJ•mol-1,b大于a |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
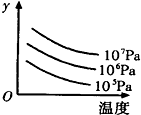 有某可逆反应aA(g)+bB(g)?cC(g);右图表示外界条件(温度、压强)的变化对上述反应的影响.下列判断正确的是( )
有某可逆反应aA(g)+bB(g)?cC(g);右图表示外界条件(温度、压强)的变化对上述反应的影响.下列判断正确的是( )| A. | a+b<c时,y轴表示平衡混合气中C的质量分数 | |
| B. | a+b<c时,y轴表示平衡混合气的平均摩尔质量 | |
| C. | △H>0时,y轴表示达到平衡时B的转化率 | |
| D. | △H>0时,y轴表示达到平衡时A的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灯光明暗程度不变 | B. | 灯光变暗 | ||
| C. | 灯光变亮 | D. | 无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com