
| 实验编号 | 合金质量(mg) | 气体体积(mL) |
| 1 | 144 | 112 |
| 2 | 288 | 224 |
| 3 | 864 | 560 |
| 硝酸的浓度 | NaOH(aq)的体积 | ||
| A. | B. | C. | D. |
| 4.0 mol/L | 1.0 mol/L | 75 mL | 99 mL |
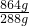 =672mL>560mL,故第3组金属有剩余,硝酸完全反应.
=672mL>560mL,故第3组金属有剩余,硝酸完全反应.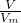 计算第3组生成的NO的物质的量,由反应3Zn+8HNO3=3Zn(NO3)2+2NO↑+4H2O、Al+4HNO3=Al(NO3)3+NO↑+2H2O可知,起氧化剂作用的硝酸为总的硝酸的
计算第3组生成的NO的物质的量,由反应3Zn+8HNO3=3Zn(NO3)2+2NO↑+4H2O、Al+4HNO3=Al(NO3)3+NO↑+2H2O可知,起氧化剂作用的硝酸为总的硝酸的 ,据此计算25mL硝酸溶液中n(HNO3)、起酸性作用的硝酸的物质的量,根据c=
,据此计算25mL硝酸溶液中n(HNO3)、起酸性作用的硝酸的物质的量,根据c= 计算原硝酸溶液的浓度;
计算原硝酸溶液的浓度;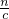 计算需要氢氧化钠溶液的最小体积.
计算需要氢氧化钠溶液的最小体积.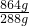 =672mL>560mL,故第3组金属有剩余,硝酸完全反应.
=672mL>560mL,故第3组金属有剩余,硝酸完全反应.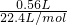 =0.025mol,由反应3Zn+8HNO3=3Zn(NO3)2+2NO↑+4H2O、Al+4HNO3=Al(NO3)3+NO↑+2H2O可知,起氧化剂作用的硝酸为总的硝酸的
=0.025mol,由反应3Zn+8HNO3=3Zn(NO3)2+2NO↑+4H2O、Al+4HNO3=Al(NO3)3+NO↑+2H2O可知,起氧化剂作用的硝酸为总的硝酸的 ,故25mL硝酸溶液中n(HNO3)=0.025mol÷
,故25mL硝酸溶液中n(HNO3)=0.025mol÷
 =4mol/L.
=4mol/L.
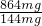 =0.024mol,根据钠离子守恒可知n(NaOH)=n(NaNO3)+n(NaAlO2)=0.075mol+0.024mol=0.099mol,故需要氢氧化钠溶液的最小体积为
=0.024mol,根据钠离子守恒可知n(NaOH)=n(NaNO3)+n(NaAlO2)=0.075mol+0.024mol=0.099mol,故需要氢氧化钠溶液的最小体积为 =0.099L=99mL,
=0.099L=99mL,

科目:高中化学 来源: 题型:
(2013?普陀区二模)取不同质量的镁铝合金分别与25mL同浓度的稀硝酸反应,测量合金的质量与产生气体的体积(标准状况),列表如下:
| ||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
(Ⅰ)甲取样品①m1 g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1 g。则样品①合金中镁的质量分数为_____________。
(Ⅱ)乙取样品②m2 g和足量的盐酸反应,然后滴加过量的氢氧化钠溶液,将沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m2 g。则样品②合金中镁的质量分数为_____________。
(Ⅲ)丙取样品③m3 g和足量的稀硫酸反应,发现固体完全溶解,标准状况下得到气体体积为V L,则样品③中m3的取值范围是____________________________________________。
(Ⅳ)丁取不同质量的样品④分别和30 mL同浓度的盐酸反应,所取合金质量与产生气体体积(标准状况下测定)如下表所示:
实验序号 | a | b | c |
合金质量/mg | 510 | 765 | 918 |
气体体积/mL | 560 | 672 | 672 |
求:(1)该盐酸的物质的量浓度。
(2)样品④中合金中镁的质量分数。
(3)在c组实验后,还需向容器中加入1.0 mol·L-1的氢氧化钠溶液多少毫升才能使剩余合金中的铝恰好完全溶解?
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市普陀区高三下学期二模化学试卷(解析版) 题型:选择题
取不同质量的镁铝合金分别与25 mL同浓度的稀硝酸反应,测量合金的质量与产生气体的体积(标准状况),列表如下:
|
实验编号 |
合金质量(mg) |
气体体积(mL) |
|
1 |
144 |
112 |
|
2 |
288 |
224 |
|
3 |
864 |
560 |
若第3个实验后向反应容器内加入足量的1.0 mol/L NaOH(aq)充分反应,使固体质量不再发生变化。硝酸的浓度及至少需要NaOH(aq)的体积是
硝酸的浓度 NaOH(aq)的体积
A. B. C. D.
4.0 mol/L 1.0 mol/L 75 mL 99 mL
查看答案和解析>>
科目:高中化学 来源:0109 期中题 题型:计算题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com