
【题目】在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)。一段时间后该反应达到平衡,测得CO的物质的量为0.5mol.则下列说法正确的是( )
CO2(g)+H2(g)。一段时间后该反应达到平衡,测得CO的物质的量为0.5mol.则下列说法正确的是( )
A.800℃下,该反应的化学平衡常数为0.25
B.427℃时该反应的平衡常数为9.4,则该反应的△H<0
C.800℃下,若继续向该平衡体系中通入1.0mol的CO(g),则平衡时CO物质的量分数为33.3%
D.800℃下,若继续向该平衡体系中通入1.0mol的H2O(g),则平衡时CO转化率为33.3%
【答案】B
【解析】
A.根据三段式进行
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始量(mol) 1 1 00
转化量(mol) 0.5 0.5 0.50.5
平衡量(mol) 0.5 0.5 0.50.5
由于反应前后体积不变,则可以用物质的量来计算平衡常数,
A、该温度下反应的平衡常数K=(0.5×0.5)/(0.5×0.5)=1,故A错误;
B.427℃时该反应的平衡常数为9.4,这说明降低温度平衡向正反应方向移动,因此正方应是放热反应,即该反应的△H<0,故B正确;
C.此时CO的转化率是0.5mol/1mol×100%=50%,800℃下,若继续向该平衡体系中通入1.0 mol的CO(g),则平衡向正反应方向移动,但CO的转化率降低,因此剩余CO的物质的量大于2mol-2mol×50%=1mol,则平衡时CO物质的量分数小于![]() ×100%=33.3%,故C错误;
×100%=33.3%,故C错误;
D、800℃下,若继续向该平衡体系中通入1.0 mol的H2O(g),则
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始量(mol) 1 2 0 0
转化量(mol) x x x x
平衡量(mol)1-x 2-x x x
因此有![]() =1,解得x=2/3,所以平衡时CO转化率,
=1,解得x=2/3,所以平衡时CO转化率,![]() ×100%=66.7%,故D错误;
×100%=66.7%,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】2019年5月23日,《南阳日报》发消息称,“水氢发动机”在当地下线,文中称,“车载水可以实时制取氢气,车辆只需加水即可行驶。”文章发布后引发广泛质疑。据报道,该发动机的核心原理是用铝粉与水进行反应得到氢气,作为发动机的燃料。美军曾经报道过“尿氢能”技术,与“水氢汽车”的原理如出一辙,纳米铝粉加尿可得大量氢气,且用尿液与铝粉反应的产氢速率比正常的水高出一倍。下列说法不正确的是( )
A.常温下铝和水的反应不能自发反应,将铝加工为精细铝粉,增大了反应接触面积,使该反应变为自发反应
B.推测尿液与铝粉反应比水快的可能原因是因为尿液呈弱酸性,金属与酸反应速率加快
C.水作为铝的氧化剂的缺点是反应生成的氢氧化铝或氧化铝会吸附在铝表面,阻碍反应进行
D.若需得到标况下体积为10L的氢气,加入的铝粉至少为8.0g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe2+
B.向Al2(SO4)3溶液中加入少量氨水:![]()
C.向明矾溶液中加入过量的氢氧化钡溶液:![]()
D.向小苏打溶液中加少量澄清石灰水:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe2O3和Cu2O是红色粉末,常作颜料。某校化学实验小组通过实验来探究红色粉末的成分是Fe2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设1:红色粉末是Fe2O3;假设2:红色粉末是Cu2O;假设3:红色粉末是Fe2O3和Cu2O的混合物
设计实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是____;若假设2成立,发生反应的离子方程式为______。
(2)经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物,设计实验计算二者的物质的量:取一定量的该固体粉末溶于500 mL未知浓度的稀硫酸溶液中,固体全部溶解,向反应后的溶液中加入Fe粉,溶液中部分离子的物质的量随Fe粉加入,变化如图所示,则Fe2O3和Cu2O的物质的量分别为____、 _______。

(3)硫酸溶液的物质的量浓度是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过滤在实验、生产、生活中有着广泛的应用。某研究性学习小组在实验室测定某含NaCl杂质的碳酸钠样品中Cl-的含量,其实验步骤如下:
①将100g样品溶于水得到溶液A。
②向A中加入稀HNO3酸化后,再加入沉淀剂B,使Cl-完全沉淀下来。
③进行如图所示操作,得到固体C,洗涤,干燥。
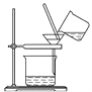
④称量得固体C的质量为2.87 g。
(1)沉淀剂B为________(填化学式)。
(2)向A中加入稀HNO3酸化的目的是_______________________。
(3)如何洗涤固体C: __________________。如果得到固体C后直接干燥、称量,会使样品中氯元素的质量分数________(填“偏大”“偏小”或“不变”)。
(4)该样品中氯元素的质量分数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,反应的化学方程式及装置图(部分连接装置省略)如图:
 +2FeCl3
+2FeCl3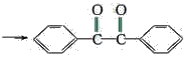 +2FeCl2+2HCl
+2FeCl2+2HCl
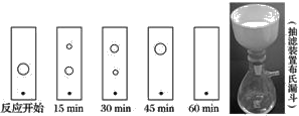

装置图中的两种玻璃仪器a为三颈烧瓶、b为球形冷凝管(或冷凝管),在反应装置中,加入原料及溶剂,搅拌下加热回流。反应结束后加热煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯。
重结晶过程:加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
根据以上信息请回答下列问题:
(1)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体___。
A.缓慢冷却溶液
B.溶液浓度较高
C.溶质溶解度较小
D.缓慢蒸发溶剂
如果溶液中发生过饱和现象,可采用____等方法促进晶体析出。
(2)试推测抽滤所用的滤纸应略___(填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。烧杯中的二苯基乙二酮晶体转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是__。
A.无水乙醇
B.饱和NaCl溶液
C.70%乙醇水溶液
D.滤液
(3)上述重结晶过程中的哪一步操作除去了不溶性杂质___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2mol B气体在2 L的密闭容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g),反应2 s后测得C的物质的量为1.2mol。下列说法不正确的是
2C(g),反应2 s后测得C的物质的量为1.2mol。下列说法不正确的是
A.用物质B表示2s内的平均反应速率为0.15 mol/(L·s)
B.用物质A表示2 s内的平均反应速率为0.3 mol/(L·s)
C.2 s后物质B的浓度为0.35 mol/L
D.2 s后物质A的转化率为30%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g) ![]() 2Z(g)、②2M(g)
2Z(g)、②2M(g) ![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:

下列判断正确的是( )
A.反应①的正反应是吸热反应
B.达到平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为14:15
C.达到平衡(Ⅰ)时,X的转化率为5/11
D.在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种3D打印机的柔性电池以碳纳米管作电极材料,以吸收ZnSO4溶液的有机高聚物为固态电解质,其电池总反应为:
![]() ,其电池结构如图1所示,图2是有机高聚物的结构片段。下列说法不正确的是
,其电池结构如图1所示,图2是有机高聚物的结构片段。下列说法不正确的是
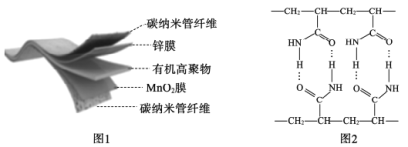
A.放电时,含有锌膜的碳纳米管纤维作电池负极
B.有机高聚物中含有的化学键有:极性键、非极性键和氢键
C.合成有机高聚物的单体是![]()
D.放电时,电极的正极反应为:MnO2+e-+H2O=MnOOH+OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com