
【题目】化合物X是一种药物合成的中间体,其结构简式如图所示。下列有关化合物X的说法正确的是( )
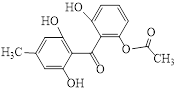
A. 化合物X的分子式为C16H16O6
B. 能发生加成反应、取代反应、消去反应
C. 1mol化合物X最多可与5molNaOH、7mol H2、4molBr2发生反应
D. 可与FeCl3溶液发生显色反应,但不能发生氧化反应
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】碳及其化合物在研究和生产中有许多重要用途.请回答下列问题:
(1)基态碳原子核外电子有__种空间运动状态,其价电子排布图为__.
(2)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为__,其碳原子杂化轨道类型为_____杂化.
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:
碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
阳离子半径/pm | 66 | 99 | 112 | 135 |
试解释为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高?。 ______________
(4)碳的一种同素异形体﹣﹣C60,又名足球烯,是一种高度对称的球碳分子.立方烷(分子式:C8H8结构是立方体:![]() 是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间八面体空隙中.则该复合型分子晶体的组成用二者的分子式可表示为__。
是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间八面体空隙中.则该复合型分子晶体的组成用二者的分子式可表示为__。

(5)碳的另一种同素异形体——石墨,其晶体结构如图所示,则石墨晶胞含碳原子个数为__个.已知石墨的密度为ρg·cm﹣3,C﹣C键长为rcm,阿伏加德罗常数的值为NA,计算石墨晶体的层间距为__cm.
(6)金刚石和石墨的物理性质差异很大,其中:熔点较高的是___________,试从结构分析___________;硬度大的是___________,其结构原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)温室效应是导致海平面上升的主要原因,引起温室效应的人为因素主要是 。
(2)为了控制温室效应,各国科学家提出了不少方法和设想。有人根据液态CO2密度大于海水密度的事实,设想将CO2液化后,送入深海海底,以减小大气中CO2的浓度。为使CO2液化,可采用的措施是 (填字母)。
A.减压、升温 B.增压、升温
C.减压、降温 D.增压、降温
(3)科学家致力于二氧化碳的“组合转化”技术研究,把过多的二氧化碳转化为有益于人类的物质。如将CO2和H2以1∶4的比例混合,通入反应器。在适当的条件下反应,可获得一种重要的能源。请完成以下化学方程式CO2+4H2![]() +2H2O。 若将CO2与H2混合,在一定条件下以1∶3的比例发生反应,可生成某种重要的化工原料和水,该化工原料可能是 (填字母)。
+2H2O。 若将CO2与H2混合,在一定条件下以1∶3的比例发生反应,可生成某种重要的化工原料和水,该化工原料可能是 (填字母)。
A.甲烷 B.乙烯 C.乙醇 D.苯
(4)下列措施能快速、有效地减缓大气中CO2增加的是 。
A.使用天然气等燃料
B.控制全球人口增长
C.植树造林,保护森林
D.立即减少煤和石油的燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述合理的是( )
A. 金属材料都是导体,非金属材料都是绝缘体
B. 棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O
C. 水电站把机械能转化成电能,而核电站把化学能转化成电能
D. 我国规定自2008年6月1日起,商家不得无偿提供塑料袋,目的是减少“白色污染”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列五种烃:①正丁烷②异丁烷③丙烷④辛烷⑤乙烷,按它们的沸点由高到低的顺序排列为
A. ④①②③⑤ B. ①④②③⑤ C. ⑤③②①④ D. ④①③⑤②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的一种核素X 的质量数为A,含N个中子,它与1H 原子组成HmX 分子。在a g HmX中所含质子的物质的量是
A. ![]() mol B.
mol B. ![]() mol
mol
C. ![]() mol D.
mol D. ![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:

(1)步骤③的离子方程式:_________________________________。
(2)步骤⑤中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是________。
(3)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过________(填试剂名称)溶液,以除去氯气。
(4)步骤⑤的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因:___________________________。
(5)步骤①中用硫酸酸化可提高Cl2的利用率,理由是_______________________。
(6)提取溴单质,采用蒸馏“溴水混合物Ⅱ”而不是蒸馏“溴水混合物Ⅰ”,请说明原因:
______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍晶体(NiSO47H2O)可用于电镀工业,可用含镍废催化剂为原料来制备。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al、Fe的单质及其他不溶杂质(不溶于酸碱)。某小组通过查阅资料,设计了如下图所示的制备流程:

已知: Ksp[Fe(OH)3]=4.0×10-38 ,Ksp[Ni(OH)2]=1.2×10-15
(1)“碱浸”过程中发生反应的离子方程式是_______________________________。
(2)操作a所用到的玻璃仪器有烧杯、________、________;操作c的名称为____________、____________、过滤、洗涤。
(3)固体①是______________;加H2O2的目的是(用离子方程式表示)_____________。
(4)调pH为2-3时所加的酸是________。
(5)操作b为调节溶液的pH,若经过操作b后溶液中c(Ni2+)=2mol·L-1,当铁离子恰好完全沉淀溶液中c(Fe3+)=1.0×10-5mol·L-1时,溶液中是否有Ni(OH)2沉淀生成?________(填“是”或“否”)。
(6)NiSO47H2O可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在放电过程中总反应的化学方程式是NiOOH+MH=Ni(OH)2+M,则NiMH电池充电过程中,阳极的电极反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:D为烃;E分子中碳元素与氢元素的质量之比6∶1,相对分子质量为44,其燃烧产物只有CO2和H2O。A的最简式与F相同,且能发生银镜反应,可由淀粉水解得到。

(1)A的结构简式为__________________。
(2)写出D→E的化学方程式:_______________________。
(3)下列说法正确的是____。
A.有机物F能使石蕊溶液变红
B.用新制的氢氧化铜无法区分有机物C、E、F的水溶液
C.等物质的量的C和D分别完全燃烧消耗氧气的量相等
D.可用饱和碳酸钠溶液除去有机物B中混有的少量C、F
E. B的同分异构体中能发生银镜反应的酯类共有2种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com