
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
 .
.
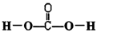
分析 (1)碳原子的成键情况主要根据与碳原子形成共价键的原子的数目确定,H2CO3中C能形成四个共价键,O能形成两个共价键,氢原子形成一个共价键;
(2)判断非金属强弱的方法很多,非金属的最高价氧化物的水化物的酸性强弱,能证明非金属强弱;非金属氢化物的稳定性,能说明非金属性强弱;非金属与氢气化合的难易程度,能说明非金属性的强弱;
(3)0.01mol/L的NaCN溶液pH=9,溶液显碱性是因为CN-离子水解,溶液中存在电荷守恒分析离子浓度大小;
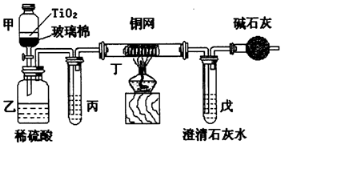
(4)①CN-的废水在催化剂TiO2作用下用NaClO氧化,使CN-转化成CNO-,还生成氯离子;CNO-在酸性条件下继续被NaClO氧化成N2与CO2,还生成氯离子、水;
②饱和食盐水除去氯化氢气体,铜网用来除去氯气;根据碳原子守恒,计算出被处理的CN-的物质的量,再利用200mL(其中CN-的浓度0.05mol/L)求出CN-被处理的百分率分析判断;
(5)碱石灰是防止空气中二氧化碳进入装置戊影响测定结果.
解答 解:(1)碳原子的成键情况主要根据与碳原子形成共价键的原子的数目确定,H2CO3中C能形成四个共价键,O能形成两个共价键,氢原子形成一个共价键,结构式为: ,
,
故答案为: ;
;
(2)a.非金属性的强弱与气态氢化物稳定性有关,气态氢化物的稳定性越强非金属性越强,故a正确;
b.最高价氧化物对应水化物酸性强弱,越强非金属性越强,故b正确;
c.Al2O3+N2+3C═2AlN+3CO,反应中C为还原剂,N2为氧化剂,说明氮气氧化性大于碳单质,能说明非金属性强弱,故c正确;
d.在周期表中的位置,同周期从左到右非金属性增强,能说明,故d正确;
故答案为:abcd;
(3)0.01mol/L的NaCN溶液pH=9,溶液显碱性是因为CN-离子水解,呈碱性的原因离子方程式表示为:CN-+H2O?HCN+OH-,溶液中存在电荷守恒,c(Na+)+c(H+)=c(OH-)+c(CN-),c(H+)<c(OH-),则c(Na+)>c(CN-),
故答案为:CN-+H2O?HCN+OH-;>;
(4)①CN-的废水在催化剂TiO2作用下用NaClO氧化,使CN-转化成CNO-,还生成氯离子,离子反应为CN-+ClO-═CNO-+Cl-,CNO-在酸性条件下继续被NaClO氧化成N2与CO2,还生成氯离子、水,离子反应为2CNO-+3ClO-+2H+═N2+2CO2+3Cl-+H2O,
故答案为;CN-+ClO-=CNO-+Cl-,2CNO-+3ClO-+2H+═N2+2CO2+3Cl-+H2O;
②乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,
故答案为:CN-+ClO-=CNO-+Cl-; 2CNO-+3ClO-+2H+=N2↑+2CO2↑+H2O+3Cl-;
②网能够和氯气反应从而除去氯气杂质,丁在实验中的作用是除去混合气体中Cl2,防止对CO2测定量的影响,则乙中产生的气体除CO2、N2外,还可能含有的杂质气体是HCl、Cl2,200mL(其中CN-的浓度0.05mol/L)混合液中含有的CN-的物质的量是:0.2L×0.05mol/L=0.01mol,根据碳原子守恒,增多生成0.01mol二氧化碳,所以石灰水过量,生成的碳酸钙的物质的量是:0.009mol,反应的CN-的物质的量是0.009mol,CN-被处理的百分率是:$\frac{0.009mol}{0.01mol}$×100%=90%,
故答案为:HCl、Cl2;90%;
(5)装置戊是吸收生成的二氧化碳来称量质量得到碳元素物质的量,装置中碱石灰的作用是防止空气中的CO2进入戊,影响对产物的测定,
故答案为:防止空气中的CO2进入戊,影响对产物的测定;
点评 本题考查了弱电解质电离平衡、盐类水解,该题是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力,侧重氧化还原反应方程式书写的考查,注意判断发生的氧化还原反应,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 盐酸滴在石灰石上:CO32-+2H+═CO2↑+H2O | |
| D. | 盐酸与饱和的澄清石灰水反应:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 .d中倒置漏斗的作用是:防倒吸,某同学认为如果想验证该反应的类型,可以取反应后烧杯d中溶液,加入稀硝酸酸化,然后加入硝酸银溶液,如果产生了淡黄色沉淀即验证了该反应的类型.试分析该同学的操作是否可行:否(填“是”或“否”),简要说明其原因:进入d烧杯被NaOH溶液吸收的除了HBr外还有Br2蒸汽,加入硝酸银仅能验证d中有溴离子,但是不能说明溴离子来自于HBr还是Br2.
.d中倒置漏斗的作用是:防倒吸,某同学认为如果想验证该反应的类型,可以取反应后烧杯d中溶液,加入稀硝酸酸化,然后加入硝酸银溶液,如果产生了淡黄色沉淀即验证了该反应的类型.试分析该同学的操作是否可行:否(填“是”或“否”),简要说明其原因:进入d烧杯被NaOH溶液吸收的除了HBr外还有Br2蒸汽,加入硝酸银仅能验证d中有溴离子,但是不能说明溴离子来自于HBr还是Br2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学事实 | 类推结论 | |
| A | 卤素单质的沸点:F2<Cl2<Br2<Iz2 | 氢化物沸点:FH<HCI<HBr<HI |
| B | 用电解熔融MgCI2可制得金属 | 用电解熔融NaCI也可以制取金属钠 |
| C | 将CO:通入Ba(NO3)2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
| D | AI与S加热时直接化合生成AI2S3 | Fe与S加热时也能直接化合生Fe2S3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO32- K+ Fe3+ Cl- | B. | NO3- K+ Mg2+ SO42- | ||
| C. | ClO- Na+ HCO3- SCN- | D. | SO42- Mg2+ Cl- H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷中混有乙烯,将其通入酸性高锰酸钾溶液中洗气 | |
| B. | 乙烯中混有二氧化硫,将其通入氢氧化钠溶液中洗气 | |
| C. | 乙炔中混有硫化氢,将其通入溴水中洗气 | |
| D. | 溴苯中混有溴,加入汽油,振荡,用汽油萃取出溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯(甲苯)KMnO4(酸化),NaOH溶液分液 | B. | 乙烷(乙烯)酸性KMnO4(溶液洗气 | ||
| C. | 乙酸乙酯(乙酸)KOH溶液分液 | D. | 苯(苯酚)浓Br2水过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数 | B. | 中子数 | C. | 质子数 | D. | 电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常情况下,它们的单质均为气体 | B. | 它们在自然界这都存在游离态形式 | ||
| C. | 每种元素都只有一种氧化物 | D. | 它们都存在对应的含氧酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com