
| 实验原理 | m=cVM |
| 实验仪器 | 托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管 |
| 实验步骤 | (1)计算:溶质NaCl固体的质量为11.7g. (2)称量:用托盘天平称取所需NaCl固体. (3)溶解:将称好的NaCl固体放入烧杯中,用适量蒸馏水搅拌. (4)转移、洗涤:将烧杯中的溶液注入容量瓶中,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也都注入容量瓶中. (5)定容:将蒸馏水注入仪器至液面离刻度线1~2cm时,改用 胶头滴管滴加蒸馏水至液面与刻度线相切. (6)摇匀:盖好瓶塞,反复上下颠倒,然后静置. |
| 思考与探究 | (7)某同学在实验步骤(6)后,发现凹液面低于刻度线,于是再向容器中滴加蒸馏水至刻度线,该同学所配置溶液是浓度< (填“>”、“=”或“<”)2.00mol/L. |
分析 试验仪器:
配制时,一般可分为以下几个步骤:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀,依据配制步骤选择需要的仪器;
实验步骤:
(1)依据m=CVM计算需要氯化钠的质量;
(3)固体称量后需要在烧杯中溶解;
(5)定容需要胶头滴管滴加蒸馏水;
思考与探究:
(7)盖好瓶塞,反复上下颠倒,会有部分液体残留在容量瓶刻度线以上,若再加蒸馏水,相当于稀释,浓度偏低.
解答 解:配制100mL2.00mol/LNaCl溶液,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、量筒、100mL容量瓶、胶头滴管,故答案为:容量瓶;
(1)配制100mL2.00mol/LNaCl溶液,需要氯化钠的质量m=2.0mol/L×0.1L×58.5g/mol=11.7g;
故答案为:11.7;
(3)固体称量后需要在烧杯中溶解,故答案为:溶解;
(4)玻璃棒在溶解固体、冷却溶液中作用为搅拌,故答案为:搅拌;
(5)定容指加蒸馏水到离刻度线2-3cm时改用胶头滴管滴加蒸馏水,直至凹液面最低点与刻度线相切,故答案为:胶头滴管;
(7)盖好瓶塞,反复上下颠倒,会有部分液体残留在容量瓶刻度线以上,若再加蒸馏水,相当于稀释,浓度偏低,故答案为:<.
点评 本题考查了一定物质的量浓度溶液的配制、仪器的选择以及误差分析,熟悉配制原理是解题关键,题目难度不大.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 熔点:MgO>CaS | B. | 熔点:Li>Na | ||
| C. | 沸点:SiCl4>CF4 | D. | 沸点:邻硝基苯酚>间硝基苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
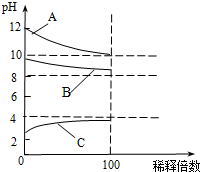 现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH
现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得溶液中水电离出c(OH-)=1.0×10-10mol•L-1 | |
| B. | 所得溶液中的c(Cu2+)=1.0×10-5mol•L-1 | |
| C. | 向所得溶液中滴加Na2S溶液会有黑色沉淀出现 | |
| D. | 除去工业废水中的Cu2+,可以用FeS作沉淀剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.下列有关a、b、c三点的说法中正确的是( )
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.下列有关a、b、c三点的说法中正确的是( )| A. | 醋酸的电离程度由大到小的顺序:b>c>a | |
| B. | 溶液的pH由大到小的顺序:a>c>b | |
| C. | 用湿润的pH试纸测量醋酸溶液的pH,测量结果均偏大 | |
| D. | 溶液中$\frac{{c(C{H_3}COOH)}}{{c(C{H_3}CO{O^-})}}$的数值不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
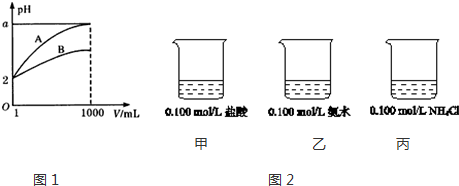
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
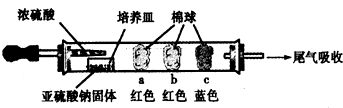
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 品红试液 | 棉球变白,微热后又恢复红色 | SO2具有漂白性,且为暂时性漂白 |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式:2OHˉ+SO2 =SO32ˉ+H2O或OHˉ+SO2=HSO3ˉ |
| c | 含淀粉的碘水 | 棉球变为白色 | 该气体具有还原性 (选填“氧化性”或“还原性”) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知某密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g),的平衡物质的量浓度c(CO2)与温度t的关系如图所示.下列说法错误的是( )
已知某密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g),的平衡物质的量浓度c(CO2)与温度t的关系如图所示.下列说法错误的是( )| A. | 平衡状态A与C相比,平衡状态A的c(CO)较小 | |
| B. | 在t2时,D点的反应速率:ν(逆)>ν(正) | |
| C. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 | |
| D. | 若t1、t2时的平衡常数分别为K1、K2,则K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1L0.1mol•L-1NaClO溶液中阴离子总数大于0.1NA | |
| B. | 7.8gNa2O2中含有的阴、阳离子总数是0.3NA | |
| C. | N2H2分子中各原子的最外层(除H外)均为8电子结构,1molN2H2中有共用电子对数目为3NA | |
| D. | 50mL18mol•L-1浓硫酸与足量铜反应,转移电子数小于0.9NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com