
| A. | 生铁的熔点低于纯铁 | B. | 运输酒精的车辆所帖标志应是 | ||
| C. | 漂白粉能在空气中长期存放 | D. | 氢氧化铝可作胃酸的中和剂 |
分析 A.生铁是碳和铁的合金,合金的熔点低于其成分物质的熔点;
B.酒精属于易燃的液体;
C.漂白粉在空气中与二氧化碳反应生成次氯酸,次氯酸见光容易分解而导致变质;
D.氢氧化铝为难溶物,能够中和胃酸中的盐酸.
解答 解:A.生铁是碳和铁的合金,合金的熔点低于其成分物质的熔点,生铁的熔点低于纯铁,故A正确;
B.酒精属于易燃的液体,故运输酒精的纸箱外应当粘贴的标志是:易燃液体,故B正确;
C.HClO虽是强氧化性的酸,但它是比碳酸还弱的酸,能与水和二氧化碳发生复分解反应,生成CaCO3和 HClO,故漂白粉不能长期在空气中放置,故C错误;
D.氢氧化铝能够与胃酸中的盐酸反应,能够作胃酸的中和剂,故D正确.
故选C.
点评 本题主要考查了合金的性质、酒精的性质、漂白粉和抗酸药等,难度不大,注意知识的积累.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:填空题
 碳和碳的化合物在人类生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在人类生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | 2p能级电子半充满 |
| B | 与A同周期,且原子核外有2个未成对电子 |
| C | 基态原子核外有6个原子轨道排有电子,且只有1个未成对电子 |
| D | 其基态原子外围电子排布为msnmpn+2 |
| E | 前四周期元素中,E元素基态原子未成对电子数最多 |
| F | 基态F+各能级电子全充满 |
 .
.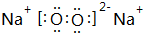 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al、Mg、Na | B. | Mg、Al、Na | C. | Na、Mg、Al | D. | Na、Al、Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热的纯碱溶液去污能力增强 | |
| B. | 配制FeCl3溶液,可加入少量的稀硫酸,以防止溶液浑浊 | |
| C. | 加热蒸干Al2(SO4)3溶液,最终能得到Al2(SO4)3晶体 | |
| D. | 利用明矾净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 尽管NO2能与水反应生成硝酸,但 NO2不属于酸性氧化物 | |
| B. | Na2O 溶于水所得溶液能导电,据此可判断 Na2O属于电解质 | |
| C. | 氨气和氯化氢气体混合后生成的NH4Cl是离子化合物,因此该反应为离子反应 | |
| D. | 某气体只含N、H 两种元素,且质量之比为14:3,则该气体一定为纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com