
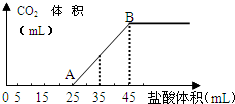
 将一定质量的碳酸钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol•L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
将一定质量的碳酸钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol•L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:分析 (1)OA段发生反应:NaOH+HCl═NaCl+H2O、Na2CO3+HCl═NaHCO3+NaCl;
(2)生成二氧化碳发生反应:NaHCO3+HCl═NaCl+H2O+CO2↑,消耗HCl体积为HCl(35-25)mL=10mL,结合方程式计算;
(3)25mL-45mL段生成二氧化碳,根据消耗HCl计算NaHCO3的物质的量,根据碳原子守恒计算Na2CO3的物质的量,消耗盐酸45mL时溶液中溶质为NaCl,根据氯离子守恒计算NaCl物质的量,再根据钠离子守恒计算NaOH物质的量,进而计算NaOH质量.
解答 解:(1)OA段发生反应:NaOH+HCl═NaCl+H2O、Na2CO3+HCl═NaHCO3+NaCl,离子方程式为:H++OH-=H2O、CO32-+H+=HCO3-,
故答案为:H++OH-=H2O、CO32-+H+=HCO3-;
(2)生成二氧化碳发生反应:NaHCO3+HCl═NaCl+H2O+CO2↑,消耗HCl体积为HCl(35-25)mL=10mL,则n(CO2)=n(HCl)=0.01L×1mol/L=0.01mol,故生成CO2的体积为0.01mol×22.4L/mol=0.224L=224mL,
故答案为:224;
(3)25mL-45mL段生成二氧化碳,该阶段消耗盐酸体积为20mL,由NaHCO3+HCl═NaCl+H2O+CO2↑,可知n(NaHCO3)=n(HCl)=0.02L×1mol/L=0.02mol,根据碳原子守恒n(Na2CO3)=n(NaHCO3)=0.02mol,消耗盐酸45mL时溶液中溶质为NaCl,根据氯离子守恒n(NaCl)=n(HCl)=0.045L×1mol/L=0.045mol,根据钠离子守恒,可知NaOH物质的量为0.045mol-0.02mol×2=0.005mol,故NaOH质量为0.005mol×40g/mol=0.2g,
故答案为:0.2;0.02mol.
点评 本题考查混合物有关计算,根据图象判断各阶段发生的反应是解题关键,注意守恒法的运用用,题目难度中等.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O?2NaOH+H2↑ | B. | Cl2+H2O?HCl+HClO | ||
| C. | NH3•H2O?NH3+H2O | D. | N2+3H2$?_{高温高压}^{催化剂}$2NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 现使用酸碱中和滴定法测定市售白醋(CH3COOH)的总酸量(g/100mL).
现使用酸碱中和滴定法测定市售白醋(CH3COOH)的总酸量(g/100mL).| 滴定次数 | 1 | 2 | 3 | 4 |
| V(样品) (mL) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) (mL) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:1 | B. | 2:1:2 | C. | 4:22:7 | D. | 8:11:14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 人们对苯及芳香烃的认识有一个不断深化的过程.
人们对苯及芳香烃的认识有一个不断深化的过程. :该结构的一氯代物有1种.
:该结构的一氯代物有1种. ,下列关于萘的说法正确的是CD(填编号)
,下列关于萘的说法正确的是CD(填编号)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com