
【题目】钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是___________,其外围电子排布式为___________。
(2)已知第四电离能大小:I4(Fe)> I4 (Co),从原子结构的角度分析可能的原因是___________。
(3)配位化学创始人维尔纳发现,取1mol配合物CoCl3·6NH3(黄色)溶于水,加人足量硝酸银溶液,产生3mol白色沉淀,沉淀不溶于稀硝酸。原配合物中络离子形状为正八面体。
①根据上述事实推测原配合物中络离子化学式为___________。
②该配合物在热NaOH溶液中发生反应,并释放出气体,该反应的化学方程式___________;生成气体分子的中心原子杂化方式为___________。
(4)经X射线衍射测定发现,晶体钴在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于___________,若该堆积方式下的晶胞参数为acm,则钴原子的半径为___________pm。
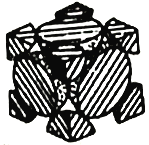
【答案】第四周期VIII族 3d74s2 Fe3+电子排布较稳定的3d5变为不稳定的3d4需要更多的能量 [Co(NH3)6]3+ [Co(NH3)6]Cl3+3NaOH=Co(OH)3↓+6NH3+3NaCl sp3 面心立方堆积 ![]() a
a![]() 1010
1010
【解析】
(1)钴的原子序数为27,在周期表中位于第四周期VIII族,电子排布式为1s22s22p63s23p63d74s2;
(2) Fe3+外围电子排布式为3d5,Co3+外围电子排布式为3d6,由此可知Fe3+从电子排布较稳定的3d5变为不稳定的3d4需要更多的能量;
(3)①1mol配合物CoCl3·6NH3(黄色)溶于水,加人足量硝酸银溶液,产生3mol白色沉淀,沉淀不溶于稀硝酸,说明Cl-是外界离子,不是配位体;络离子形状为正八面体,则说明Co3+与6个NH3形成配位络离子;
②根据以上分析,该配合物为[Co(NH3)6]Cl3,与热NaOH溶液中发生反应,放出气体应为氨气;NH3分子的中心原子的价电子对数为![]() =4,故杂化方式为sp3;
=4,故杂化方式为sp3;
(4)由图可知,该堆积方式属于面心立方堆积;
钴在面心立方堆积中,钴原子处于顶点和面心,设钴原子的半径为r,则晶胞立方体面对角线长为4r,若该堆积方式下的晶胞参数为acm,则(4r)2=a2+a2,解得r=![]() acm=
acm=![]() a
a![]() 1010pm。
1010pm。
(1)钴的原子序数为27,在周期表中位于第四周期VIII族,电子排布式为1s22s22p63s23p63d74s2,其外围电子排布式为3d74s2;
故答案为:第四周期VIII族;3d74s2;
(2) Fe3+外围电子排布式为3d5,Co3+外围电子排布式为3d6,由此可知Fe3+从电子排布较稳定的3d5变为不稳定的3d4需要更多的能量,所以第四电离能大小:I4(Fe)> I4 (Co);
故答案为:Fe3+电子排布较稳定的3d5变为不稳定的3d4需要更多的能量;
(3)①1mol配合物CoCl3·6NH3(黄色)溶于水,加人足量硝酸银溶液,产生3mol白色沉淀,沉淀不溶于稀硝酸,说明Cl-是外界离子,不是配位离子;络离子形状为正八面体,则说明Co3+与6个NH3形成配位络离子。则络离子化学式为[Co(NH3)6]3+;
②根据以上分析,该配合物为[Co(NH3)6]Cl3,与热NaOH溶液中发生反应,放出气体应为氨气,则化学方程式[Co(NH3)6]Cl3+3NaOH=Co(OH)3↓+6NH3+3NaCl;NH3分子的中心原子的价电子对数为![]() =4,故杂化方式为sp3;
=4,故杂化方式为sp3;
故答案为:[Co(NH3)6]3+;[Co(NH3)6]Cl3+3NaOH=Co(OH)3↓+6NH3+3NaCl;sp3;
(4)由图可知,该堆积方式属于面心立方堆积;
钴在面心立方堆积中,钴原子处于顶点和面心,设钴原子的半径为r,则晶胞立方体面对角线长为4r,若该堆积方式下的晶胞参数为acm,则(4r)2=a2+a2,解得r=![]() acm=
acm=![]() a
a![]() 1010pm。
1010pm。
故答案为:面心立方堆积;![]() a
a![]() 1010。
1010。


科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是________,操作②的名称是____________。
(2)试剂a是____________(填化学式,下同),试剂b是__________,固体B是____________。
(3)加入试剂a所发生反应的化学方程式为__________________________________。
加入试剂b所发生反应的化学方程式为____________________________________。
(4)该方案能否达到实验目的:__________________________(填“能”或“不能”)。若不能,应如何改进?(若能,此问不用回答)__________。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是____的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组在实验室制备氨气,并进行有关氨气的性质探究.
![]() 该小组同学加热生石灰与氯化铵的混合物制取干燥的氨气.
该小组同学加热生石灰与氯化铵的混合物制取干燥的氨气.
![]() 应该选用的仪器及装置有
应该选用的仪器及装置有![]() 填字母
填字母![]() ______ .
______ .
![]() 生石灰与氯化铵反应生成氨气的化学方程式为 ______ .
生石灰与氯化铵反应生成氨气的化学方程式为 ______ .
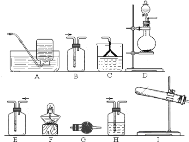
![]() 该小组同学设计如图所示装置探究氨气的还原性.
该小组同学设计如图所示装置探究氨气的还原性.

在上述过程会同时发生多个反应,写出其中属于置换反应的化学方程式 ______ ![]() 若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为 ______ .
若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为 ______ .
![]() 该小组同学以氨气和二氧化碳为原料制备碳酸氢铵.
该小组同学以氨气和二氧化碳为原料制备碳酸氢铵.
![]() 甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳.合适的方案是 ______
甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳.合适的方案是 ______ ![]() 填“甲”或“乙”
填“甲”或“乙”![]() ,原因是 ______ .
,原因是 ______ .
![]() 检验产物中有
检验产物中有![]() 的方法为 ______ .
的方法为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芬太尼(结构式如图)是一种强效的类阿片止痛剂,起效迅速而作用时间极短。当它与药物联合使用时,通常用作疼痛药物或麻醉剂。下列说法正确的是

A. 它的分子式是C22H27N2O B. 它和苯是同系物
C. 它属于烃的衍生物 D. 药物可以过量使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含溴化氢的废液中提取溴单质,下列说法中能达到实验目的的是( )
A.用装置 氧化废液中的溴化氢
氧化废液中的溴化氢
B.用装置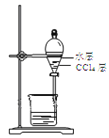 分离油层和水层
分离油层和水层
C.用装置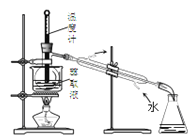 分离四氯化碳和液溴
分离四氯化碳和液溴
D.用仪器 密封存放单质溴
密封存放单质溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g)在2L的密闭容器中进行,半分钟后N2的物质的量增加了0.6mol。此反应的平均速率v(X)为
A. v(NH3)=0.02mol·L-1·s-1
B. v(O2)=0.01mol·L-1·s-1
C. v(N2)=0.02mol·L-1·s-1
D. v(H2O)=0.02mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯苯是一种重要的有机合成原料,用氯苯合成染料中间体F的两条路线如下图所示。
路线1: 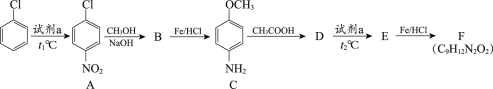
路线2: 
(1)试剂a为________。
(2)A→B的反应类型为取代反应,该反应的化学方程式为________。
(3)B→C的反应类型为________。
(4)C与CH3COOH的相对分子质量之和比D的相对分子质量大18,D→E的取代反应发生在甲氧基(—OCH3)的邻位,F的结构简式为________。
(5)G的结构简式为________。
(6)有机物I与对苯二甲酸(![]() )发生聚合反应的化学方程式为_____。
)发生聚合反应的化学方程式为_____。
(7)I与CH3COOH反应生成的有机产物除F外,还可能有________(写出结构简式)。
(8)满足下列条件的C的同分异构体有________种。①与FeCl3溶液发生显色反应②分子中含有—NH2③苯环上有3种氢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com