
化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用.下列实验中所选用的仪器合理的是( )
①用50mL量筒取5.2mL稀硫酸; ②用分液漏斗分离苯和四氯化碳的混合物;③用托盘天平称量11.7g氯化钠晶体;
④用碱式滴定管取23.10mL溴水; ⑤用瓷坩埚灼烧各种钠的化合物;⑥用250mL容量瓶配制250mL 0.2mol/L的NaOH溶液.
A. ①②④ B. ②③④⑥ C. ③⑥ D. ③⑤⑥
考点: 计量仪器及使用方法;过滤、分离与注入溶液的仪器.
专题: 化学实验常用仪器.
分析: ①在实验室量取液体时,因为量程太大,会使区分度增大,而加大误差;量程太小,需量取多次,也会加大误差,采用就近原则进行解答;
②对互不相溶的两层液体,静置后分层,则可使用分液漏斗来分离;
③托盘天平精确到0.1g;
④溴水显酸性,有强氧化性;
⑤瓷坩埚中含有二氧化硅,与NaOH在加热下反应;
⑥根据溶液的体积确定容量瓶的规格.
解答: 解:①在实验室量取液体时,因为量程太大,会使区分度增大,而加大误差;量程太小,需量取多次,也会加大误差,采用就近原则,所以不能用50mL量筒量取5.2mL稀硫酸,故①错误;
②苯和四氯化碳能相互溶解,所以不能用分液漏斗分离,故②错误;
③托盘天平精确到0.1g,故可用托盘天平称量11.7g氯化钠晶体,故③正确;
④溴水有强氧化性,会腐蚀碱式滴定管的橡胶管,故④错误;
⑤瓷坩埚中含有二氧化硅,与NaOH在加热下反应,而使坩埚炸裂,故⑤错误;
⑥配制250mL 0.2mol/L的NaOH溶液可用250mL容量瓶,故⑥正确.
故选C.
点评: 本题考查化学实验常用仪器,难度不大,注意实验的基本操作方法和注意事项.


科目:高中化学 来源: 题型:
制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应2FeCl3+Cu=2FeCl2+CuCl2向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A. 烧杯中有铜无铁 B. 烧杯中铁、铜都无
C. 烧杯中铁、铜都有 D. 烧杯中有铁无铜
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,其化学键类型完全相同的是( )
|
| A. | HCl 和KCl | B. | NH3 和H2O | C. | SiO2 和NaCl | D. | CO2 和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
有四种物质的量浓度相等、且都由一价阳离子A+和B+及一价阴离子X﹣和Y﹣组成的盐溶液.据测定常温下AX和BY溶液的pH=7,AY溶液的pH>7,BX溶液的pH<7,由此判断不水解的盐是( )
|
| A. | BX | B. | AX | C. | AY | D. | BY |
查看答案和解析>>
科目:高中化学 来源: 题型:
在100℃时,将0.40mol的二氧化氮气体充入2L真空的密闭容器中,每隔一段时间就对该容器内的物质进行分析,得到数据如表所示:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为 mol•L﹣1•s﹣1.
(2)n3 n4(填“>”、“<”或“=”),该反应的平衡常数为 (保留小数点后一位).
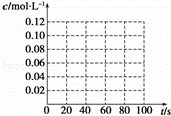
(3)若在相同情况下,最初向该容器中充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是 mol•L﹣1,假设在80s时达到平衡,请在如图中画出并标明该条件下此反应中N2O4和NO2的浓度随时间变化的曲线.
(4)达到平衡后,如升高温度,气体颜色会变深,则升高温度后,反应2NO2(g)⇌Ν2O4(g)的平衡常数将 (填“增大”、“减小”或“不变”).
(5)达到平衡后,如向该密闭容器中再充入0.32mol氦气,并把容器体积扩大为4L,则平衡将 (填“向左移动”、“向右移动”或“不移动”).
查看答案和解析>>
科目:高中化学 来源: 题型:
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+═Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol.下列说法正确的是( )
A. 反应中硫元素被氧化,所有铁元素均被还原
B. 氧化剂是Fe3+,氧化产物是Cu2+
C. 反应中转移电子的物质的量为xmol
D. 反应结束后,测得溶液中三种金属离子的总物质的量为ymol,则原Fe3+的总物质的量为(y﹣x)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
为达到相应的实验目的,下列实验的设计或操作最合理的是( )
A. 为测定一定浓度的NaOH溶液放置空气中是否部分转化为Na2CO3,用酚酞作指示剂,用标准盐酸溶液滴定
B. 为观察Mg条在CO2气体中的燃烧,在一个集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶底部
C. 为比较Cl与S元素的非金属性强弱,相同条件下,测定相同浓度的NaCl溶液和Na2S溶液的pH值
D. 给盛有铜与浓硫酸的试管加热,发现试管底部出现灰白色固体,为检验其中的白色固体为无水硫酸铜,可直接向试管中加入适量水
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、E为前四周期五种元素,分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X、Y、Z的氢化物都比同族元素氢化物的沸点高.E原子外围未成对电子数是同周期中最多的.W元素的电离能数据见下表(kJ•mol﹣1):
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
请回答:
(1)E元素基态原子的价电子排布式是: ,周期表中位置 ;
(2)X、Y、Z、W四种元素的电负性大小关系: (填元素符号,用“>”连接);
(3)写出W2Y2的电子式 ;
(4)X、Z可以形成一种共价化合物,其中两种元素最外层电子数都达到8,则其分子的空间构型是: ;
(5)X的氢化物易溶于水的原因是:
(6)用氢键表示式写出Z的氢化物水溶液中可能存在的氢键 .
(7)肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)
若该反应中有4mol N﹣H键断裂,则形成的π键有 mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com