
分析 (1)镍元素的化合价降低了2价,磷元素的化合价升高的2价,根据原子守恒结合电荷守恒可得配平的方程式;
(2)化合价升高元素所在的反应物是还原剂,化合价降低元素在反应中被还原;
(3)根据化合价变化来确定电子转移情况;
(4)根据反应方程式来确定物质的量之间的关系;
(5)根据题意:制备碱金属的普通氧化物一般是用碱金属还原对应的过氧化物、硝酸盐或亚硝酸盐来回答.
解答 解:(1)反应①中镍元素的化合价降低了2价,磷元素的化合价升高的2价,由电子、电荷守恒及原子守恒可知,离子反应为Ni2++H2PO2-+1H2O═Ni+1H2PO3-+2H+,
故答案为:1;1;1H2O;1;1;2H+;
(2)反应式①中P的化合价升高,所以还原剂是H2PO2-,Ni元素的化合价降低,所以被还原元素是Ni,故答案为:H2PO2-;Ni;
(3)1mol H2PO3-,反应中转移电子的物质的量为1mol×(4-2)=2mol,故答案为:2mol;
(4)从二个化学镀镍反应分析,若生成1molNi会生成1molH2PO3-,若生成1molP会生成2molH2PO3-,共生成3molH2PO3-,
故答案为:3;
(5)①金属钠和过氧化钠之间反应可以得到氧化钠,即Na2O2+2Na=2Na2O,故答案为:Na2O2+2Na=2Na2O;
②金属钾可以和硝酸钾之间反应生成氧化钾和氮气,即2KNO3+10K=6K2O+N2↑,故答案为:2KNO3+10K=6K2O+N2↑.
点评 本题考查学生氧化还原反应的配平以及电子守恒的计算,注意题目信息的应用是关键,难度中等.


科目:高中化学 来源: 题型:选择题
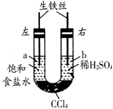 如图在盛有CCl4的U形管左右两端分别加入饱和食盐水和稀硫酸,使两边液面相平,再塞上插有铁丝的塞子,密封好,放置一段时间.下列说法错误的是( )
如图在盛有CCl4的U形管左右两端分别加入饱和食盐水和稀硫酸,使两边液面相平,再塞上插有铁丝的塞子,密封好,放置一段时间.下列说法错误的是( )| A. | 左右两边铁丝腐蚀速率一样快 | B. | 左右两边负极反应均为Fe-2e→Fe2+ | ||
| C. | 左边液面高于右边液面 | D. | 左右两边溶液的pH均升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +1 | B. | +3 | C. | +4 | D. | +6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
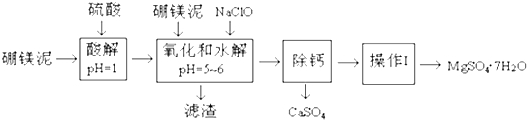
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30 L | B. | 20 L | C. | 10 L | D. | 40 L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
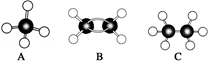 现有A、B、C三种烃,其球棍模型图:
现有A、B、C三种烃,其球棍模型图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验内容 | 实验目的 | |
| A | 向1mL 0.1mol/L NaOH溶液中加入2mL0.1mol/L CuSO4溶液 ,振荡后滴加0.5mL葡萄糖溶液,加热未出现红色沉淀 | 证明葡萄糖中含有醛基 |
| B | 向1mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生 白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下, Ksp>Ksp |
| C | 测定同温度下相同浓度的碳酸钠和硫酸钠溶液的pH, 前者大于后者 | 证明碳元素非金属性弱于硫 |
| D | 向某溶液中滴加少量稀NaOH溶液,将湿润的红色石蕊试 纸置于试管口试纸不变蓝 | 证明溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com