
| A. | 非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价 | |
| B. | 只有非金属元素才能形成含氧酸盐 | |
| C. | 主族元素中的金属元素形成的最高价阳离子一定与上一周期稀有气体元素的原子核外电子排布相同 | |
| D. | 非金属元素的最高价含氧酸都具有强氧化性 |
分析 A.根据化合价的代数和为零分析;
B.金属元素也能形成含氧酸盐;
C.Ga3+的原子核外电子排布与Ar的原子核外电子排布不相同;
D.碳酸、硅酸等不具有强氧化性.
解答 解:A.非金属元素R所形成的含氧酸盐(MaROb)中,O为-2价,M、R元素的化合价一定为正价,而且化合价的代数和为零,故A正确;
B.金属元素也能形成含氧酸盐,如Mn元素形成高锰酸钾,故B错误;
C.Ga在第四周期,Ar在第三周期,Ga3+的原子核外电子排布与Ar的原子核外电子排布不相同,故C错误;
D.碳酸、硅酸等不具有强氧化性,所以非金属元素的最高价含氧酸不一定具有强氧化性,故D错误.
故选A.
点评 本题考查了元素周期表和元素周期律知识,侧重于学生的分析能力和基本概念知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
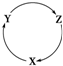 下表各组物质中,不满足下图物质一步转化关系的选项是( )
下表各组物质中,不满足下图物质一步转化关系的选项是( )| 选项 | X | Y | Z |
| A | NO2 | HNO3 | NO |
| B | Cu | CuSO4 | Cu(OH)2 |
| C | Al2O3 | NaAlO2 | Al(OH)3 |
| D | SiO2 | Na2SiO3 | H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 3 | ② | ③ | ⑧ | ⑩ | ||||
| 4 | ① | ⑨ |
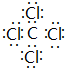 ,该分子含有极性(填“极性”或“非极性”)键;⑤元素形成的单质的结构式为N≡N⑧元素形成简单离子的结构示意图为
,该分子含有极性(填“极性”或“非极性”)键;⑤元素形成的单质的结构式为N≡N⑧元素形成简单离子的结构示意图为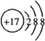 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③中加入过量的试剂是为了完全除去相应的杂质离子 | |
| B. | ③中加入过量Na2CO3溶液仅为了完全除去Ca2+ | |
| C. | 因为Mg(OH)2难溶而MgCO3微溶,所以用NaOH除Mg2+效果比用Na2CO3好 | |
| D. | ⑤中可以通过边滴加边测定溶液pH的方法,控制加入的盐酸“适量” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

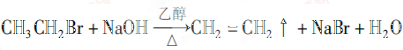 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的颜色随核电荷数的增加逐渐加深 | |
| B. | 元素的最高化合价均为+7 | |
| C. | 从上到下原子半径递增 | |
| D. | 从上到下非金属性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
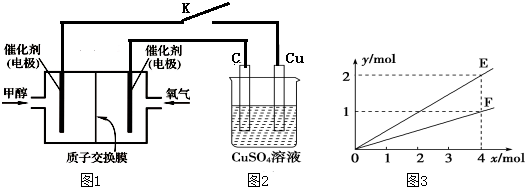
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
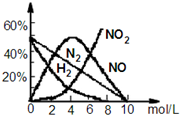 HNO3是极其重要的化工原料.工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的. 据此完成下列试题:
HNO3是极其重要的化工原料.工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的. 据此完成下列试题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com