
氯碱工业是高耗能产业,一种将电解池与燃料电池相结合的新工艺可以节能30%以上。在这种工艺设计中,相关物料的传输与转化关系如图所示,其中甲、乙、丙、丁均为石墨电极。
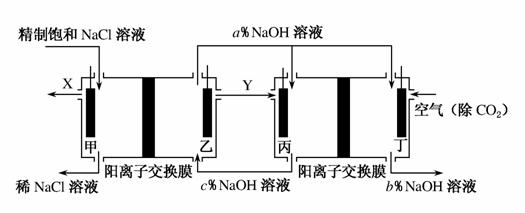
(1)为了有效除去粗盐中混有的Ca2+、Mg2+、SO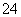 ,下列选项中所加试剂(均为溶液)及加入顺序均合理的是________(填选项字母)。
,下列选项中所加试剂(均为溶液)及加入顺序均合理的是________(填选项字母)。
A.先加足量Ba(OH)2,再加足量Na2CO3,最后加入适量稀盐酸
B.先加足量NaOH,再加足量Na2CO3,然后加足量BaCl2,最后加入适量稀盐酸
C.先加足量Na2CO3,再加足量BaCl2,然后加足量NaOH,最后加入适量稀盐酸
D.先加足量Ba(NO3)2,再加足量NaOH,然后加足量Na2CO3,最后加入适量稀盐酸
(2)丙电极为________极,该电极的电极反应式为____________________________________。
(3)乙电极附近溶液的pH________(填“增大”“减小”或“不变”)。
(4)若装置中通过0.5 mol e-,则理论上生成标准状况下X的体积为________。
(5)图中NaOH溶液的质量分数a%、b%、c%由大到小的顺序为________。
(6)这样设计的主要节能之处在于(任写1条)____________________________。
解析 (1)应先加入足量Ba(OH)2除去SO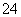 ,然后加入足量Na2CO3除去Ca2+、Mg2+、Ba2+等,过滤后加入适量稀盐酸可除去OH-和CO
,然后加入足量Na2CO3除去Ca2+、Mg2+、Ba2+等,过滤后加入适量稀盐酸可除去OH-和CO ,A项正确。(2)电解饱和NaCl溶液,阴极区得到H2和NaOH溶液,故乙电极为电解池的阴极,丙电极通入的为H2,作燃烧电池的负极,该电极的电极反应式为H2-2e-+2OH-===2H2O。(3)因乙电极为电解池的阴极,发生反应2H2O+2e-=
,A项正确。(2)电解饱和NaCl溶液,阴极区得到H2和NaOH溶液,故乙电极为电解池的阴极,丙电极通入的为H2,作燃烧电池的负极,该电极的电极反应式为H2-2e-+2OH-===2H2O。(3)因乙电极为电解池的阴极,发生反应2H2O+2e-= ==H2↑+2OH-,有OH-生成,故pH增大。(4)根据2Cl-+2H2O
==H2↑+2OH-,有OH-生成,故pH增大。(4)根据2Cl-+2H2O Cl2↑+H2↑+2OH-可知,每转移2 mol e-生成22.4 L(标准状况下)Cl2,若转移0.5 mol e-,则生成5.6 L(标准状况下)Cl2。(5)电解饱和NaCl溶液得到a%NaOH溶液,一部分a%NaOH溶液进入丙电极,根据(2)中丙电极的电极反应式可知,OH-作为反应物被消耗,所以c%小于a%;另一部分a% NaOH溶液进入燃料电池正极,燃炓电池正极发生反应O2+4e-+2H2O===4OH-,燃料电池中的阳离子交换膜只允许阳离子通过,反应后NaOH溶液的浓
Cl2↑+H2↑+2OH-可知,每转移2 mol e-生成22.4 L(标准状况下)Cl2,若转移0.5 mol e-,则生成5.6 L(标准状况下)Cl2。(5)电解饱和NaCl溶液得到a%NaOH溶液,一部分a%NaOH溶液进入丙电极,根据(2)中丙电极的电极反应式可知,OH-作为反应物被消耗,所以c%小于a%;另一部分a% NaOH溶液进入燃料电池正极,燃炓电池正极发生反应O2+4e-+2H2O===4OH-,燃料电池中的阳离子交换膜只允许阳离子通过,反应后NaOH溶液的浓 度升高,即a%小于b%,所以b%>a%>c%。(6)燃料电池能将化学能转化为电能,可以补充电解池消耗的电能;可以提高产出碱液的浓度;降低能耗。
度升高,即a%小于b%,所以b%>a%>c%。(6)燃料电池能将化学能转化为电能,可以补充电解池消耗的电能;可以提高产出碱液的浓度;降低能耗。
答案 (1)A (2)负 H2-2e-+2OH-===2H2O (3)增大 (4)5.6 L (5)b%>a%>c% (6)燃料电池可以补充电解池消耗的电能;提高产出碱液的浓度;降低能耗


科目:高中化学 来源: 题型:
在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后 ( )
A.整个溶液变紫色 B.整个溶液变为棕黄色
C.上层为褪色,下层为紫红色 D.下层褪色,上层紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组微粒在指定的溶液中一定能大量共存的是( )
A.加入金属镁产生H2的溶液中:NH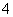 、Na+、SO
、Na+、SO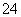 、CH3COO-
、CH3COO-
B.含有大量ClO-的溶液中:K+、Na+、NO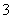 、SO
、SO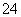
C.c(Cu2+)=0.1 mol·L-1的溶液中:H+、NH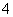 、Br-、CO
、Br-、CO
D.含有大量MnO 的溶液中:H+、SO
的溶液中:H+、SO 、Cl-、CH3CH2OH
、Cl-、CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某反应A(g)+B(g)C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题:
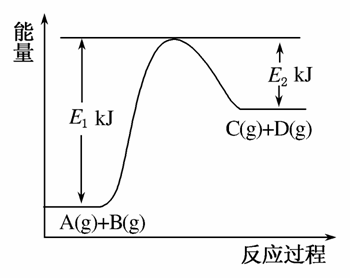
(1)该反应是________反应(填“吸热”或“放热”),该反应的ΔH=________kJ·mol-1(用含E1、E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量________(填“一定高”“一定低”或“高低不一定”)。
(2)若在反应体系中加入催化剂使反应速率增大,则E1和E2的变化是:E1________,E2________,ΔH________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
500 mL NaNO3和Cu(NO3)2的混合溶液中c(NO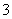 )=
)= 0.3 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后
0.3 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后 ,两极均收集到1.12 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
,两极均收集到1.12 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(Na+)=0.2 mol·L-1
B.电解后溶液中c(H+)=0.2 mol·L-1
C.上述电解过程中共转移0.4 mol电子
D.电解后得到的Cu的物质的量为0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。
请回答下列问题:
(1)Y基态原子的电子排布式是________;Z所在周期中第一电离能最大的主族元素是________。
(2)XY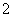 离子的立体构型是________;R2+的水合离子中,提供孤电子对的原子是________。
离子的立体构型是________;R2+的水合离子中,提供孤电子对的原子是________。
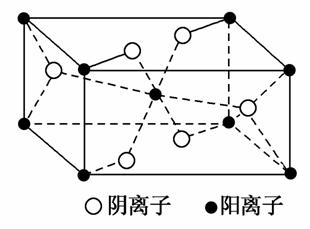
(3)Z与某元素形成的化合物的晶胞如图所示,晶胞中阴离子与阳离子的个数比是________。
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
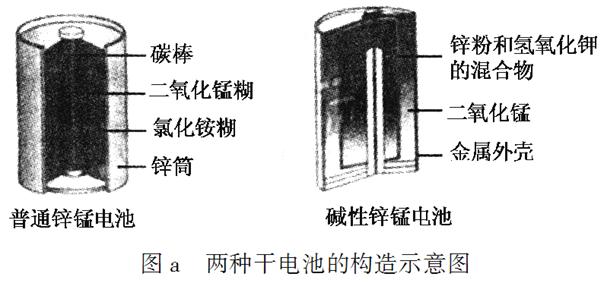
锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造如图a所示。
回答下列问题:
(1)普通锌锰电池放电时发生的主要反应为:
Zn+2NH4Cl+2MnO2===Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是________,电解质的主要成分是________,正极发生的主要反应是________________________________。
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是__________________________________________________________。
(2)图b表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。

①图b中产物的化学式分别为A________,B________。
②操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液和一种黑褐色固体,该反应的离子方程式为________________________________________。
③采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有五种可溶性物质A、B、C、D、E,它们所含阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO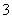 、CO
、CO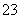 、X中的一种。
、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是________和________(填化学式)。
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质记为C,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕黄色沉淀,向该沉淀中滴入稀硝酸沉淀部分溶解,最后留有白色沉淀不再溶解。则X为________。
A.SO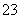 B.SO
B.SO
C.CH3COO- D.SiO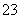
(3)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的________(填相应的离子符号)。有关反应的离子方程式为____________。
(4)利用上述已经确定的物质,可以检验出D、E中的阳离子。请简述实验操作步骤、现象及结论:________________________________________
______________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能达到目的的是( )
A.只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液
B.将NH4Cl溶液蒸干制备NH4Cl固体
C.用萃取分液的方法除去酒精中的水
D.用可见光束照射以区别溶液和胶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com