
| A、化学键的键能由大到小:金刚石>碳化硅>硅>锗 |
| B、熔沸点由高到低:氯化钠>氧化铝>硅>二氧化碳 |
| C、硬度由大到小:C60>碳化硅>铁>氯化钠 |
| D、导电性能由强到弱:金>铜>石墨>二氧化碳 |


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
| A、常温下,H2CO3分子不可能存在于pH=8的碱性溶液中 |
| B、在99mL的醋酸铵溶液中加入1mL pH=2的盐酸,所得溶液pH=4 |
| C、常温下,由醋酸铵溶液呈中性可推知NH4HCO3溶液pH<7 |
| D、物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2c(Na+)=c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径的大小顺序:r(Z)>r(W)>r(Y)>r(X) |
| B、元素Y的简单气态氢化物的热稳定性比W的弱 |
| C、化合物Z2Y2与X2Y反应时,Z2Y2既是氧化剂又是还原剂 |
| D、由X、Y、Z、W四种元素组成的化合物其水溶液一定显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、白醋中滴入石蕊试液呈红色 |
| B、白醋加入豆浆中有沉淀产生 |
| C、蛋壳浸泡在白醋中有气体放出 |
| D、白醋中c(H+)=0.01 moL/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入AgNO3溶液后加热蒸干 |
| B、加入适量盐酸后加热蒸干 |
| C、加水溶解后通入适量氯气再加热蒸干 |
| D、加水溶解后滴入适量溴水再加热蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:
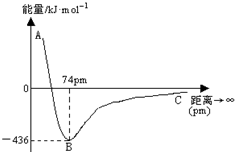 当两个氢原子核间距为74pm时,两个原子轨道发生最大程度的重叠,此时体系的能量最低.如图表示两个气态基态氢原子相互接近形成氢气分子时,体系能量随两个原子的核间距离变化的曲线图,下列关于氢原子形成氢分子说法不正确的有( )
当两个氢原子核间距为74pm时,两个原子轨道发生最大程度的重叠,此时体系的能量最低.如图表示两个气态基态氢原子相互接近形成氢气分子时,体系能量随两个原子的核间距离变化的曲线图,下列关于氢原子形成氢分子说法不正确的有( )| A、氢分子比氢原子稳定 |
| B、氢原子的半径约为37pm |
| C、形成一个H-H键吸收436kJ能量 |
| D、当核间距接近74pm时,形成了氢分子中s~s σ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1分子H2和Cl2反应,放出热量184.6kJ |
| B、1mol H2 (g)完全反应生成2mol HCl(g),放出的热量为184.6kJ |
| C、在101 kPa、25℃的条件下,1mol H2(g)和1mol Cl2(g)完全反应生成2mol HCl(g)放出的热量为184.6kJ |
| D、在101 kPa、25℃的条件下,1mol H2和1mol Cl2完全反应生成2mol HCl(g)吸收的热量为184.6kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com