
| A、1 mol H2 |
| B、0.5molNH3 |
| C、6.02×1023个的CH4分子 |
| D、0.3molH3PO4 |
科目:高中化学 来源: 题型:
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O (g) | K3 | ||
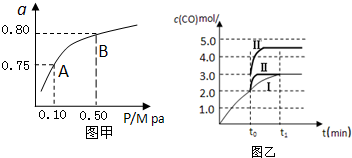
查看答案和解析>>
科目:高中化学 来源: 题型:
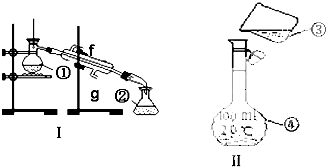
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小于0.9mol |
| B、等于0.9mol |
| C、在0.9mol与1.8mol之间 |
| D、等于1.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 |
| B、2.8gN2和2.24 LCO组成的混合物中质子数为1.4 NA |
| C、将1molNH4NO3溶于一定浓度的稀氨水中,溶液呈中性,若不考虑挥发,溶液中一定含有NA个NH4+ |
| D、25℃时,1LpH=13的 Ba(OH)2溶液中含有的OH-数目为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中含有1molNaCl |
| B、1L溶液里含有NaCl58.5克 |
| C、58.5gNaCl溶于941.5g水中 |
| D、1molNaCl溶于1L水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
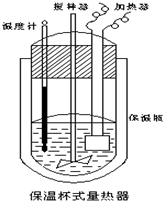 在如图所示的量热计中,将100mL 0.50mol?L-1CH3COOH溶液与100mL0.55mol?L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J?℃-1生成溶液的比热容为4.184J?g-1?℃-1,溶液的密度均近似为1g?mL-1.
在如图所示的量热计中,将100mL 0.50mol?L-1CH3COOH溶液与100mL0.55mol?L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J?℃-1生成溶液的比热容为4.184J?g-1?℃-1,溶液的密度均近似为1g?mL-1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com