
【题目】向一定量的NaOH 溶液中逐滴加入AlCl3溶液,生成沉淀A1(OH)3的量随AlCl3加入量的变化关系如右图所示。则下列离子组在对应的溶液中一定能大量共存的是

A. a点对应的溶液中:Na+、Fe3+、SO42-、HCO3-
B. b点对应的溶液中:Na+、S2-、SO42-、Cl-
C. c点对应的溶液中:Ag+、Ca2+、NO3-、F-
D. d点对应的溶液中:K+、NH4+、I-、CO32-
【答案】B
【解析】向一定量的NaOH溶液中逐滴加入AlCl3溶液,开始时NaOH过量,发生的反应是:AlCl3+4NaOH=NaAlO2+2H2O,当NaOH完全反应后再加入AlCl3溶液,反应的方程式是:AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl,所以bc段对应的是AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl,b之前发生的是AlCl3+4NaOH=NaAlO2+2H2O。
A项,根据上述分析,在a点,NaOH尚未完全反应,有NaOH剩余,会与Fe3+反应生成沉淀、与HCO3反应生成CO32-和H2O,故不能大量共存,A错误;B项,在b点,NaOH恰好完全反应,溶液中溶质是NaAlO2,与Na+、S2、SO42、Cl互相之间都不反应,故可以大量共存,B正确;C项,在c点,溶液中的NaAlO2恰好与AlCl3完全反应,溶液中的溶质是NaCl,Cl-会和Ag+反应生成沉淀,故不能大量共存,所以C错误;D项,d点,AlCl3溶液过量,Al3+会与CO32-发生双水解反应,故不能大量共存,所以D错误。此题答案选B。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】以NaCl等为原料制备KClO4的过程如下: ①在无隔膜、微酸性条件下,发生反应:NaCl+H2O﹣NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3 .
③一定条件下反应:4KClO3 ![]() 3KClO4+KCl,将产物分离得到KClO4 .
3KClO4+KCl,将产物分离得到KClO4 .
(1)电解时,产生质量为2.13g NaClO3 , 同时得到H2的体积为L(标准状况).
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是 .
(3)该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验: 准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4﹣全部转化为Cl﹣(反应为:3KClO4+C6H12O6═6H2O+6CO2↑+3KCl),加入少量K2CrO4溶液作指示剂,用0.20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积为21.00mL.滴定达到终点时,产生砖红色Ag2CrO4沉淀.
①已知:Ksp(AgCl)=1.8×10﹣10 , Ksp(Ag2CrO4)=1.1×10﹣12 , 若c(CrO42﹣)=1.1×10﹣4mol/L,则此时c(Cl﹣)=mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.48 g Na和Na2O2的混合物与足量的水反应,在标准状况下得到672 mL混合气体,将混合气体用电火花引燃恰好完全反应,则Na和Na2O2的物质的量之比为
A.2∶1 B.1∶2 C.1∶1 D.3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=;若其他条件不变,容器体积缩小为1L,则K值 . (增大、减小或不变);若K300°C>K350°C , 则该反应是热反应.
(2)用O2表示从0~2s内该反应的平均速率v=;
(3)能说明该反应已达到平衡状态的是
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离除NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香叶醛(  )是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(
)是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(  ).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
A.两者互为同分异构体
B.两者均能与溴水反应加成反应
C.香叶醛的一种同分异构体可能是芳香醇
D.对异丙基甲苯的分子式为C10H14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在反应式:aFeCl2+bKNO3+cHCl=dFeCl3+eKCl+fX+gH2O中,若b=1,d=3,则X的分子式为____________。
(2)完成以下氧化还原反应的离子反应方程式,并标出电子转移的方向和数目:___________
___CrI3+____Cl2+______——____K2CrO4+____KIO4+___KCl+______
【答案】 NO 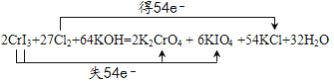
【解析】(1)根据原子守恒得:a=d=3、e=b=1,根据氯原子守恒,则c=4,再由氢原子守恒,则g=2,所以最后根据N、O原子守恒,推出X的化学式为NO,故答案为:NO;
(2)假设CrI3的系数为1,根据Cr元素守恒,K2CrO4的系数为1,根据I守恒,KIO4的系数为3,根据化合价升降守恒,Cl2的系数为![]() ,根据Cl守恒,KCl的系数为27,根据质量守恒定律,反应物中需要一种含有K和O元素的物质,应该为KOH,则生成物中含有H2O,根据K守恒,KOH的系数为32,则H2O的系数为16,因此配平为2CrI3+27Cl2+64KOH =2K2CrO4+6KIO4+54KCl+32H2O,电子转移的方向和数目表示为:
,根据Cl守恒,KCl的系数为27,根据质量守恒定律,反应物中需要一种含有K和O元素的物质,应该为KOH,则生成物中含有H2O,根据K守恒,KOH的系数为32,则H2O的系数为16,因此配平为2CrI3+27Cl2+64KOH =2K2CrO4+6KIO4+54KCl+32H2O,电子转移的方向和数目表示为: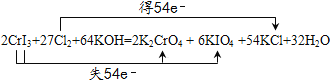 ,故答案为:
,故答案为: 。
。
【题型】填空题
【结束】
26
【题目】A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去,反应可以在水溶液中进行)。
![]()
(1)若A、B、C三种物质的溶液均显碱性,焰色反应均为黄色,C受热分解转化为B
①A与过量W转化为C的总反应的离子方程式_______________。
②B溶液中通入W生成C的离子方程式_______________。
③A溶液与C溶液反应的化学方程式为_______________。
(2)若B的溶液显黄色,一定条件下B的饱和溶液可与沸水反应生成红褐色分散系
①C溶液中加入氢氧化钠溶液的现象_______________。
②B与W转化为C的离子反应方程式_______________。
③一定条件下W与水反应的化学方程式_______________。
(3)若A为NaOH,且C为白色沉淀
①C为_______________。
②A与某金属单质也可生成B,该反应的离子方程式_______________。
③C溶于A的离子反应方程式_______________。
④B与W混合生成白色沉淀的离子反应方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气的制取、储存和利用一直是化学领域研究的热点.H2O热分解可以得到H2和O2 , 高温下水分解体系中主要气体的体积分数与温度的关系如图所示.下列有关说法正确的是( ) 
A.图中A,B表示的粒子依次是O和H
B.图中A,B表示的粒子依次是H+和O2﹣
C.图中A,B重新生成水时的活化能等于0
D.图中A,B重新生成水时的活化能大于0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有①②③三瓶体积相等,浓度都是1molL﹣1的HCl溶液,将①加热蒸发至体积减少一半,在②中加入少量CH3COONa固体,(加入后溶液仍呈强酸性),③不作改变,然后以酚酞作指示剂,用NaOH溶液滴定上述三种溶液,所消耗的NaOH溶液体积是( )
A.①=③>②
B.③>②>①
C.③=②>①
D.①=②=③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com