

分析 (1)煤的加工分为干馏、气化和液化,煤的液化分为直接液化和间接液化;
(2)逆流通人惰性气体增大接触面积,充分进行热交换,故答案为:充分进行热交换;
(3)根据反应的关系式:S~SO2~H2SO4计算生成硫酸的质量,进而计算98%浓硫酸的质量;
(4)根据工艺图可知,SO2被氧气在Ca(OH)2存在的环境下氧化为石膏CaSO4•2H2O,据此写出化学方程式,从石灰石浆液的成本较熟石灰低;
(5)根据反应物为CO2和H2O(g)产物为CH4和O2来书写化学方程式;催化剂受光照时间的影响.
解答 解:(1)煤的加工分为干馏、气化和液化,煤的液化分为直接液化和间接液化,煤的直接液化是将煤在氢气和催化剂作用下通过加氢裂化转变为液体燃料的过程,因过程主要采用加氢手段,故又称煤的加氢液化法,煤的间接液化是先把煤炭在高温下与氧气和水蒸气反应,使煤炭全部气化、转化成合成气(一氧化碳和氢气的混合物),然后再在催化剂的作用下合成为液体燃料的工艺技术,
故答案为:气化;直接液化技术;间接液化技术;
(2)逆流通人惰性气体可充分进行热交换,故答案为:充分进行热交换;
(3)每天燃烧掉的烟煤中S的质量=200t×1.6%=3.2t,
S~SO2~H2SO4
32 98
3.2t×365 m(H2SO4)
m(H2SO4)=$\frac{3.2t×365×98}{32}$=3577t,
故得到98%的浓硫酸的质量为:$\frac{3528t}{98%}$=3650t,
故答案为:3650;
(4)根据工艺图可知,SO2被氧气在Ca(OH)2存在的环境下氧化为石膏CaSO4•2H2O,故化学方程式为:2SO2+O2+2Ca(OH)2+4H2O=2CaSO4•2H2O,而由于石灰石浆液的成本较熟石灰低,故使用石灰石浆液而不用熟石灰,故答案为:2SO2+O2+2Ca(OH)2+4H2O=2CaSO4•2H2O;石灰石浆液的成本较熟石灰低;
(5)根据反应物为CO2和H2O(g)产物为CH4和O2可知化学方程式为:CO2+2H2O(g)$\frac{\underline{\;催化剂\;}}{光照}$CH4+2O2;光照t小时后催化剂Ⅱ作用下CH4的产量开始高于催化剂I,说明光照能提高催化剂的活性,故答案为:CO2+2H2O(g)$\frac{\underline{\;催化剂\;}}{光照}$CH4+2O2;催化剂的活性受光照时间的影响.
点评 本题考查了煤的综合利用和化学方程式的书写,综合性较强,应注意的是煤的综合利用是高频考点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3He原子中的质子在原子核外空间内一定轨道上绕核做高速运动 | |
| B. | 3He原子不是微小的实心球体 | |
| C. | 3He原子是不能再分的微粒 | |
| D. | 3He的最外层电子数为2,易与其他物质发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1中,插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 图2中,一段时间后会出现白色沉淀-灰绿色沉淀-红褐色沉淀的现象 | |
| C. | 图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| D. | 图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)25℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g)2NH3(g)△H=-92.4kJ/mol 反应过程如图.
(1)25℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g)2NH3(g)△H=-92.4kJ/mol 反应过程如图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | ||||||
| D | E | F | |||||
| C | I | G | H |
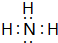 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程:
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H2O?CO2↑+H2O+OH- | B. | HS-+H2O?H3O++S2- | ||
| C. | Fe3++3H2O?Fe(OH)3↓+3H+ | D. | CO32-+H2O?HCO3-+OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com