
| n |
| V |


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
| A、相同质量时消耗的HCl:Na2CO3>NaHCO3 |
| B、相同物质的量时消耗的HCl:Na2CO3>NaHCO3 |
| C、与同浓度的硫酸反应放出气泡的速率:NaHCO3<Na2CO3 |
| D、热稳定性:NaHCO3<Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
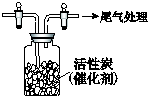 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若金属没有剩余,反应中转移的电子数目为2y NA | ||
| B、若金属全部溶解,则溶液中一定含有Fe3+ | ||
C、当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-
| ||
| D、若金属全部溶解,且产生336mL气体(标准状况),则b=0.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、仅①④ | B、仅①②④ |
| C、除⑤外 | D、全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com