
| A、为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱物质的量相等 |
| B、在酸、碱中和滴终点时不慎滴入过量标准溶液,可用装有待测液的滴定管再滴入一定量溶液进行调整 |
| C、配制0.1mol/L的盐酸500ml,应选用的仪器有:胶头滴管、烧杯、玻璃棒、天平、500ml容量瓶 |
| D、将食用盐溶于水,然后滴入淀粉溶液,来检验食盐是否是加碘食盐 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 (1)Na2SO3和Na2S是硫元素的两种重要化合物,请回答下列问题:
(1)Na2SO3和Na2S是硫元素的两种重要化合物,请回答下列问题:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、两个装置中阳极都为Al,接通电源后,均失电子发生还原反应 |
| B、两装置中阴极都为C,但由于电解质溶液不同,阴极放电离子种类不同 |
| C、电解一段时间后,撤去电源与电极,充分振荡烧杯后,甲中有白色沉淀,乙中没有 |
| D、电解过程中两装置pH均不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、粉末中含有的Al和Fe2O3的物质的量之比为1:1 |
| B、铝热反应后的固体混合物只有Al2O3和Fe |
| C、溶于盐酸后所得的溶液中只有FeCl2和AlCl3 |
| D、若将该Al和 Fe2O3粉末直接投入到足量的氢氧化钠中可产生3.36L H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用溶解、过滤的方法分离KNO3和NaCl固体的混合物 |
| B、除去混在镁粉中的少量铝粉,加氢氧化钠溶液后过滤 |
| C、由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来 |
| D、将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
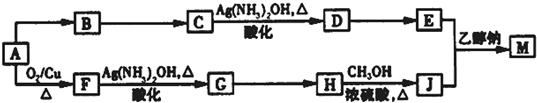
 (R、R′、R″代表相同或不相同的烃基).
(R、R′、R″代表相同或不相同的烃基).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、饱和氯水中 Cl-、NO3-、Na+、SO32- |
| B、强酸性的溶液中 C6H5O-、K+、SO42-、Br- |
| C、Na2S溶液中 SO42-、K+、Cl-、Cu2+ |
| D、强碱性的溶液中 NO3-、I-、Na+、AlO2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com