
【题目】把2.1g CO与H2组成的混合气体与足量的O2充分燃烧后,立即将产物全部通入到足量的Na2O2固体中,则固体的质量增加了( )
A.2.1 g
B.3.6 g
C.7.2 g
D.无法确定
【答案】A
【解析】解:CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应,
2CO+O2 ![]() 2CO2 , 一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2═2Na2CO3+O2 , 质量增重△m=2Na2CO3﹣2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;
2CO2 , 一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2═2Na2CO3+O2 , 质量增重△m=2Na2CO3﹣2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;
2H2+O2 ![]() 2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应:2H2O+2Na2O2═4NaOH+O2 , 质量增重△m=2H2O﹣O2=2H2 , 可知反应后固体增加的质量为氢气质量,
2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应:2H2O+2Na2O2═4NaOH+O2 , 质量增重△m=2H2O﹣O2=2H2 , 可知反应后固体增加的质量为氢气质量,
故过氧化钠固体增重等于CO和H2的质量之和为2.1g,
故选A.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 由CO2和O2组成的混合物中共有NA个分子,其中所含原子总数可能为![]()
B. 10 g质量分数为46%的乙醇水溶液中含有的氢原子总数为0.6NA
C. 常温常压下的33.6 L氯气与27 g铝充分反应,转移电子数为3NA
D. NA个Fe(OH)3与1L3mol·L-1HI溶液完全反应后,溶液中c(I-)为2mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在溶液中能大量共存的是
A. K+、H+、SO42-、OH- B. H+、Ca2+、NO3-、CO32-
C. Na+、Al3+、HCO3-、OH- D. Na+、Cu2+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列方程式:
(1)纯碱的电离方程式:_____
(2)实验室制备乙酸甲酯的化学反应方程式:_____
(3)做Cl2的相关实验时常用烧碱溶液处理尾气,发生的离子反应方程式:_____
(4)碱性氢氧燃料电池常用KOH溶液做电解质溶液,其正极电极反应式:_____
(5)已知中和热为57.3KJ/mol,写出Ba(OH)2溶液与稀盐酸反应的热化学方程式:_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36 号元素),对 比中学常见元素周期表思考扇形元素周期表的 填充规律,并用化学用语.回答下列问题:

(1)若①~⑩分别代表十种元素,则⑧代表的元素在常见周期表中的位置是____________
(2)比较元素最高价氧化物对应水化物的碱性:②_____________⑥(填“>”或“<”)
(3)写出一种由①、④、⑤三种元素形成的常见离子化合物:___________,设计一个简单的实验检验其阳离子的存在:___________________。
(4)用电子式表示⑥、⑨形成化合物的过程:_______________。
(5)①、③、⑤三种元素形成的18 电子结构的化合物是近年来燃料电池研究领域的新宠,写出用它作燃料,②的最高价氧化物对应的水化物作电解质的燃料电池的负极反应式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2KMnO4═K2MnO4+MnO2+O2↑,将0.1mol KMnO4固体加热一段时间后,收集到a molO2;向反应后残留的固体中加入足量的浓盐酸,又收集到b molCl2 , 此时Mn元素全部以Mn2+的形式存在于溶液中(注:KMnO4和 K2MnO4以及 MnO2都能与浓盐酸反应并生成Mn2+).
(1)2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中的还原产物是(填化学式),反应中若产生0.3mol的气体则有mol的电子转移.
(2)a+b的最大值为 , a+b最小值为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作_____剂。
(2)自然界Cr主要以+3价和+6价(Cr2O72-)存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。写出离子方程式:_____________________________
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是_________________________________。
(4)由铝土矿生产纯净的氧化铝,流程如下:
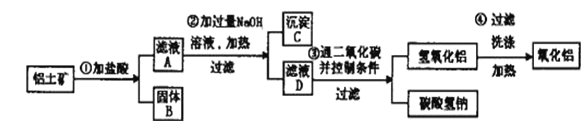
①第一步操作后,若在固体B中加入氢氧化钠溶液_______________(填”会”或”不会”)发生反应。
②验证滤液A中是否含Fe3 +,可取少量滤液A并加入____________(填试剂名称),现象是_________________________________。
③在整个操作过程中______________(填“是”或“否”)有氧化还原反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com