
| 滴定序号 | 待测液体积 | 所消耗盐酸标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
| c(HCl)×V(HCl) |
| V(NaOH) |
| 20.10+20.00+19.90 |
| 3 |
| 0.002mol×10×40g/mol |
| 1g |
| c(HCl)×V(HCl) |
| V(NaOH) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、该氖原子的相对原子质量可以表示为
| ||
| B、该氖原子的相对原子质量可以表示为aNA | ||
C、W g该氖原子的物质的量一定是
| ||
| D、12b=NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
试验编号 | T/K | V水/ml | V(Na2S2O3)/ml | V(H2SO4)/ml | 实验目的 |
| ① | 298 | 10 | 5 | 5 | 实验①和②探究温度对该反应速率的影响. 实验①和③探究 对化学反应速率的影响. 实验①和④探究 对化学反应速率的影响. |
| ② | 308 | 10 | 5 | 5 | |
③ | 298 | Vx | 10 | 5 | |
| ④ | 298 | 10 | 5 | 5 |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体于试管中,加适量蒸馏水溶解 | |
| 步骤2:向试管中加入 | |
| 步骤3:取 | 若有白色沉淀生成,证明固体中混有Na2SO4;若无白色沉淀生成,证明固体中无Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
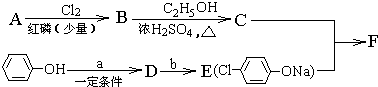
| Cl2 |
| 红磷(少量) |
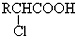 ,
,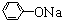 +RCl→
+RCl→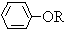 +NaCl
+NaCl查看答案和解析>>
科目:高中化学 来源: 题型:
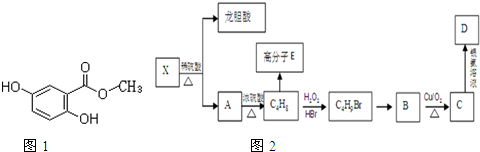
| H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
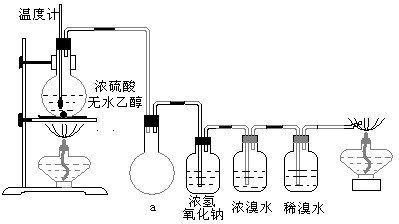
查看答案和解析>>
科目:高中化学 来源: 题型:
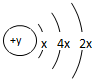 ,D在同周期元素中原子半径最小,据此填空:
,D在同周期元素中原子半径最小,据此填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com