
【题目】已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示。
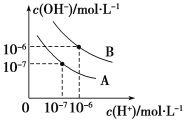
(1)25 ℃时,将10 mL pH=a的盐酸与100 mL pH=b的Ba(OH)2溶液混合后恰好中和,则a+b=________。
(2)95 ℃时,将0.02 mol·L-1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合(假设溶液的体积变化忽略不计),所得混合液的pH=________。
(3)25 ℃时Ksp(AgCl)=1.8×10-10,若向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸(假设溶液的体积变化忽略不计),混合后溶液中Ag+的浓度为________ mol·L-1,pH为________。
(4)25 ℃时Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=1×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下欲除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10-6 mol·L-1),需调节溶液的pH范围为____________。
【答案】13 10 1.8×10-7 2 5.0<pH<7.1
【解析】
(1)酸碱恰好中和,则盐酸中n(H+)等于氢氧化钡中n(OH-);
(2)根据图象判断该温度下水的离子积,然后计算出混合液中氢氧根离子浓度,再结合该温度下水的离子积计算出所带溶液中氢离子浓度及溶液的pH;
(3)首先计算n(AgNO3)和n(HCl),判断反应的过量情况,再计算剩余溶液中c(Cl-)或c(Ag+)=![]() ;溶液中氢离子不参加反应,先计算混合溶液中c(H+),再计算pH;
;溶液中氢离子不参加反应,先计算混合溶液中c(H+),再计算pH;
(4)pH=7.1时Mn(OH)2开始沉淀,室温下,除去MnSO4溶液中的Fe3+、Al3+,结合Al(OH)3完全变成沉淀时的pH、Fe(OH)3完全变成沉淀时的pH分析判断。
(1)氯化氢和氢氧化钡都是强电解质,酸碱恰好中和,则盐酸中n(H+)等于氢氧化钡中n(OH-),所以10-a mol/L×0.01L=1014-b mol/L×0.1L,则a+b=13,故答案为a+b=13;
(2)在曲线B中,水的离子积为:10-6×10-6=10-12,0.02mol/L的Ba(OH)2溶液中c(OH-)=0.04mol/L,NaHSO4溶液的浓度为0.02mol/L,c(H+)=0.02mol/L,当二者等体积混合后,溶液中的c(OH-)=![]() =0.01mol/L,则c(H+)=
=0.01mol/L,则c(H+)=![]() mol/L =10-10mol/L,该溶液的pH=10,故答案为10;
mol/L =10-10mol/L,该溶液的pH=10,故答案为10;
(3)n(AgNO3)=0.018mol/L×0.05L=0.0009mol,n(HCl)=0.020mol/L×0.05L=0.001mol>n(AgNO3),所以HCl有剩余,剩余溶液中c(Cl-)=![]() mol/L=10-3mol/L,c(Ag+)=
mol/L=10-3mol/L,c(Ag+)=![]() =
=![]() mol/L=1.8×10-7mol/L;溶液中氢离子不参加反应,则混合溶液中c(H+)=
mol/L=1.8×10-7mol/L;溶液中氢离子不参加反应,则混合溶液中c(H+)=![]() =0.01mol/L,则溶液的pH=2,故答案为1.8×10-7;2;
=0.01mol/L,则溶液的pH=2,故答案为1.8×10-7;2;
(4)pH=7.1时Mn(OH)2开始沉淀,室温下,除去MnSO4溶液中的Fe3+、Al3+,氢氧化铝完全变成沉淀时的pH:Ksp[Al(OH)3]=1×10-33=c(Al3+)×c3(OH-),c(Al3+)=1×10-6molL-1,解得:c(OH-)=1×10-9molL-1,c(H+)=1×10-5molL-1,此时pH=5,同理Fe(OH)3完全变成沉淀时,pH约为3.5,因此除去MnSO4溶液中的Fe3+、Al3+的pH范围是:5.0<pH<7.1,故答案为5.0<pH<7.1。


科目:高中化学 来源: 题型:
【题目】用如图实验装置进行实验不能达到目的是( )
选项 | 反应及实验目的 | 试剂X | 试剂Y |
|
A | 电石与饱和食盐水混合,检验乙炔气体 | CuSO4溶液 | 酸性KMnO4溶液 | |
B | 二氧化锰与浓盐酸混合加热,验证氯、溴、碘单质氧化性依次减弱 | NaBr溶液 | KI溶液 | |
C | 乙醇与浓硫酸加热至170℃,证明发生了消去反应 | NaOH溶液 | Br2的CCl4溶液 | |
D | 乙酸溶液与碳酸钠固体混合,探究乙酸、碳酸和苯酚的酸性强弱 | 饱和NaHCO3溶液 | 苯酚钠溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯![]() 可用作杀虫剂,通常条件下为无色液体,熔点为
可用作杀虫剂,通常条件下为无色液体,熔点为![]() ,沸点为
,沸点为![]() 。在潮湿空气中“发烟”;
。在潮湿空气中“发烟”;![]() 以上开始分解,生成二氧化硫和氯气,长期放置也可分解,制备时以活性炭为催化剂,反应的热化学方程式为
以上开始分解,生成二氧化硫和氯气,长期放置也可分解,制备时以活性炭为催化剂,反应的热化学方程式为![]()
![]() ,所用装置如图所示。下列叙述错误的是
,所用装置如图所示。下列叙述错误的是![]()
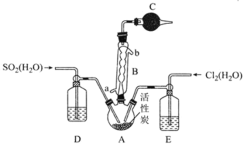
A.球形冷凝管B应从a口进水b口出水
B.可通过观察D和E中气泡产生速率控制通入A中的![]() 和
和![]() 的体积比
的体积比
C.仪器C,D,E中盛放的试剂依次为无水氯化钙、浓硫酸、浓硫酸
D.长期放置的硫酰氯液体会发黄的原因是溶解了氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是
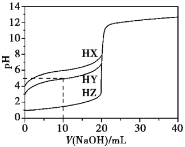
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线,可得Ka(HY)≈10—5
C.若将0.1000 mol·L-1酸HX加水稀释,其溶液中c(H+)·c(X-)增大
D.HY与HZ混合,达到平衡时:c(H+)=![]() + c(Z-)+c(OH-)
+ c(Z-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
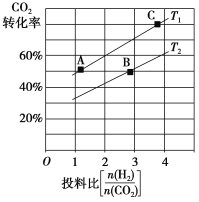
【题目】(1)工业上用CO2和H2反应合成二甲醚,反应的热化学方程式为:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH=-130.8 kJ/mol。请回答:
CH3OCH3(g)+3H2O(g) ΔH=-130.8 kJ/mol。请回答:
①一定条件下,上述反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是________(填序号)。
a.逆反应速率先增大后减小
b.H2的转化率增大
c.反应物的体积百分含量减小
d.容器中的n(CO2)/n(H2)值变小
②在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率v(CH3OCH3)=________;KA、KB、KC三者的大小关系是_____________。
③上述合成二甲醚的过程中,提高CO2的转化率可采取的措施有_______________ (任写两种)。
(2)用氨水吸收CO2可得到NH4HCO3溶液。若常温下,NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11,在NH4HCO3溶液中,c(NH4+)________c(HCO3-)(填“>”、“<”或“=”),试计算常温下反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=___________;NH4HCO3溶液中物料守恒表达式为_________。
NH3·H2O+H2CO3的平衡常数K=___________;NH4HCO3溶液中物料守恒表达式为_________。
(3)绿色“二甲醚燃料电池”在酸性溶液中负极的电极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一个体积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一个体积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加固体碳的量 ②保持压强不变,充入Ar使体系体积增大
②将容器压缩体积 ④保持体积不变,充入Ar使体系压强增大
A. ①③B. ①④C. ①②D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物苯等在ZnCl2存在下,用甲醛和极浓盐酸处理,发生氯甲基化反应,在有机合成上甚为重要。下列有关该反应的说法正确的是 ( )
![]() +HCHO+HCl
+HCHO+HCl![]()
![]() +H2O
+H2O
A.有机产物A的分子式为C7H6Cl
B.有机产物A分子中所有原子均共平面
C.反应物苯是煤干馏的产物之一,是易挥发、易燃烧、有毒的液体
D.有机产物A的同分异构体(不包括自身)共有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自20世纪80年代以来建立起的沼气发酵池,其生产的沼气用作燃料,残渣(沼渣)中除含有丰富的氮、磷、钾等常量元素外,还含有对作物生长起重要作用的硼、铜、铁、锌、锰、铬等微量元素,是一种非常好的有机肥。请回答下列问题:
(1)现代化学中,常利用___________上的特征谱线来鉴定元素。
(2)下列微粒基态的电子排布中未成对电子数由多到少的顺序是__________(填字母)。
a.Mn2+ B.Fe2+ C.Cu D.Cr
(3)P4易溶于CS2,难溶于水的原因是___________。
(4)铜离子易与氨水反应形成[Cu(NH3)4]2+配离子。
①[Cu(NH3)4]2+中提供孤电子对的成键原子是__________。
②研究发现NF3与NH3的空间构型相同,而NF3却难以与Cu2+形成配离子,其原因是___________。
(5)某晶胞中各原子的相对位置可用如图所示的坐标系表示:
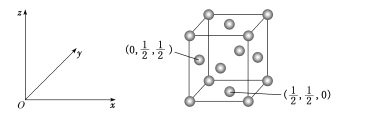
在铁(Fe)的一种立方晶系的晶体结构中,已知2个Fe原子坐标是(0,0,0)及(![]() ,
,![]() ,
,![]() ),且根据均摊法知每个晶胞中有2个Fe原子。
),且根据均摊法知每个晶胞中有2个Fe原子。
①根据以上信息,推断该晶体中原子的堆积方式是__________,
②已知晶体的密度为ρg·cm-3,Fe的摩尔质量是M g·mol-1,阿伏加德罗常数为NA,晶体中距离最近的两个铁原子之间的距离为_________ pm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ(1)尼泊金酯(![]() )是国际上公认的广谱高效食品防腐剂,是国家允许使用的食品添加剂。下列对尼泊金酯的判断不正确的是__________(填选项序号)。
)是国际上公认的广谱高效食品防腐剂,是国家允许使用的食品添加剂。下列对尼泊金酯的判断不正确的是__________(填选项序号)。
a. 能发生水解反应
b. 能与FeCl3溶液发生显色反应
c. 分子中所有原子都在同一平面上
d. 与浓溴水反应时,1mol尼泊金酯消耗1molBr2
(2)写出“间甲基苯乙烯”的结构简式:__________。
(3)写出“苯酚钠中通入少量的二氧化碳”的化学方程式:__________。
Ⅱ.已知某反应为:
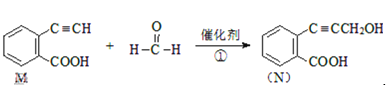 。
。
(4)M分子中官能团名称__________。
(5)1mol M完全燃烧需要__________ molO2。
(6)有机物N不可发生的反应为______。
A.氧化反应 B.取代反应 C.消去反应 D.还原反应 E.加成反应
(7)物质N与H2反应生成的P(结构简式为![]() )发生缩聚反应产物的结构简式为_____________________。
)发生缩聚反应产物的结构简式为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com