
 (1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
分析 (1)根据盖斯定律来求反应的焓变,然后根据反应放出的热量与物质的量成正比来解答;
(2)①根据温度升高化学平衡向着吸热方向进行;
②根据增加氢气的物质的量化学平衡向着正反应方向移动;
(3)500s时,△c(N2O5)=5.00mol/L-3.52mol/L=1.48mol/L,结合v=$\frac{△c}{△t}$计算.
解答 解:(1)①N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol,
②N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol,
③2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,
由盖斯定律①×2-②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=905kJ/mol;
则17g即1mol氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为$\frac{1}{4}$×905kJ≈226.3kJ,
故答案为:226.3kJ;
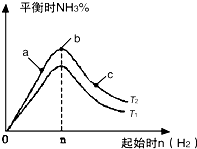
(2)①反应为放热反应,温度升高,化学平衡向着吸热方向进行,从T1到T2反应物氨气的量增加,即平衡正向移动,故T1<T2,故答案为:低于;
②b点代表平衡状态,c点又加入了氢气,故平衡向右移动,氮气的转化率增大,故答案为:c;
(3)500s时,△c(N2O5)=5.00mol/L-3.52mol/L=1.48mol/L,则v(N2O5)=$\frac{△c}{△t}$═0.00296mol•L-1•s-1,由速率之比等于化学计量数之比可知,v(NO2)=0.00296mol•L-1•s-1×2=0.00592 mol•L-1•s-1;
故答案为:0.00592 mol•L-1•s-1.
点评 本题主要考查了盖斯定律、外界条件对平衡的影响,反应速率的计算,难度中等,根据课本知识即可完成.


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 如图所示的化学反应为放热反应 | |
| B. | 化学反应中有物质变化也有能量变化 | |
| C. | 需要加热的化学反应不一定是吸热反应 | |
| D. | 断裂化学键消耗能量,形成化学键放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | Z | M |
| W |
| A. | 原子半径大小关系为:W>Y>Z>M>X | |
| B. | 最高价氧化物对应的水化物酸性:W<Y<Z | |
| C. | 分子式为X5YZM2的化合物中含有离子键和共价键 | |
| D. | 元素Y、W的单质一定属于同种类型的晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2在①中是氧化剂,在②中是还原剂 | |
| B. | 在①中每生成1 mol O2,转移的电子数为1.204×1024 | |
| C. | Mn2+在①中是还原产物,在②中是氧化产物 | |
| D. | 在二氧化锰催化作用下,1 mol H2O2分解生成22.4 L O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com