
| 元素 | O | P | |
| 电离能/KJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
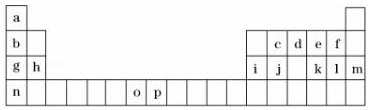
分析 由元素在周期表的位置可知,a为H,b为Li,c为C,d为N,e为O,f为F,g为Na,h为mH,i为Al,j为Si,k为S,l为Cl,m为Ar,n为K,o为Mn,p为Fe,
(1)Mn的原子序数为25,结合能量最低原理和构造原理书写电子排布式;
(2)d与a反应的产物为NH3,有3个N-H键,且N原子有一对孤电子对;
(3)非金属性越强,电负性越大;
(4)原子轨道中电子处于全满、全空、半满时最稳定.
解答 解:由元素在周期表的位置可知,a为H,b为Li,c为C,d为N,e为O,f为F,g为Na,h为mH,i为Al,j为Si,k为S,l为Cl,m为Ar,n为K,o为Mn,p为Fe,
(1)Mn的原子序数为25,由能量最低原理和构造原理可知其电子排布式为1s22s22p63s23p63d54s2,故答案为:1s22s22p63s23p63d54s2;
(2)d与a反应的产物为NH3,有3个N-H键,且N原子有一对孤电子对,则N原子为sp3杂化,故答案为:sp3;
(3)非金属性越强,电负性越大,则d、e、f三种元素的电负性大小顺序为F>O>N,故答案为:F>O>N;
(4)原子轨道中电子处于全满、全空、半满时最稳定,Mn2+的3d轨道电子排布为半满状态较稳定,则气态o2+再失去一个电子比气态p2+再失去一个电子难,
故答案为:Mn2+的3d轨道电子排布为半满状态较稳定.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、电子排布、电负性比较为解答的关键,侧重分析与应用能力的考查,注意(4)为解答的难点,题目难度不大.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | 22.4g | B. | 11.2g | C. | 5.6g | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)═c(H+)+c( HA-) | B. | c(Na+)═2c(A2-)+2c(HA-) | ||
| C. | c(A2-)+c(HA-)+c(H2A)═0.1mol•L-1 | D. | c(Na+)+c(H+)═c(OH-)+c(HA-)+2c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鉴别甲苯和苯:向甲苯和苯中分别滴入酸性KMnO4溶液,振荡,观察是否褪色 | |
| B. | 制取溴苯:将铁屑、溴水、苯混合加热 | |
| C. | 实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸 | |
| D. | 向2mL2%的CuSO4溶液中加入几滴1%的NaOH溶液,振荡后再加入0.5mL有机物X,加热后未出现砖红色沉淀,说明X结构中不含有醛基 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铜跟浓HNO3反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| B. | 向氯化铝溶液中加入过量氨水:Al3++3OH-═AlO2-+2H2O | |
| C. | 向水通入中NO2:3NO2+H2O═2H++2NO3-+NO | |
| D. | NH4Cl溶液和AgNO3溶液混合:NH4Cl+Ag +═Ag Cl↓+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
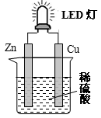
| A. | 铜是负极,电子从铜片经导线流向锌片 | |
| B. | 大多数氢离子在锌片上获得电子被还原 | |
| C. | 装置中存在“化学能→电能→光能”的转换 | |
| D. | 如果将硫酸换成西红柿汁,导线中不会有电子流动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③④ | C. | ①②③④⑤ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com