
【题目】用50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热. 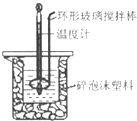
起始温度t1/℃ | 终止温度t2/℃ | 温度差 | |||
HCl | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(1)在该实验中,量取50mL盐酸或NaOH溶液,需要用到的玻璃仪是;
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是;
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指温度;
(4)计算该实验发生中和反应时放出的热量为kJ[中和后生成的溶液的比热容c=4.18J(g℃)﹣1 , 稀溶液的密度都为1gcm﹣3];
(5)如果用50mL 0.55mol/L的氨水(NH3H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是 .
【答案】
(1)量简和胶头滴管
(2)减少实验过程中的热量损失
(3)完全反应后混合溶液的最高
(4)1.34
(5)NH3?H2O是弱电解质,电离需要吸热(或生成的盐会水解,要吸收热量等)
【解析】解:(1)在该实验中,量取50mL盐酸或NaOH溶液,需要用到的玻璃仪是量筒和胶头滴管,所以答案是:量简和胶头滴管;(2)中和热测定实验中,必须尽量减少实验过程中热量的损失,所以答案是:减少实验过程中的热量损失;(3)氢氧化钠溶液与盐酸完全反应后混合溶液的最高温度为终止温度,所以答案是:完全反应后混合溶液的最高;(4)第三次得到温度差误差较大,应该舍弃,所以平均温度差为: ![]() =3.2℃,溶液的质量为:100ml×1g/ml=100g,则该反应中放出的热量为:Q=mc△T=100g×4.18J/(g℃)×3.2℃=1340J,即1.34kJ,所以答案是:1.34 kJ;(5)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,所以答案是:NH3H2O是弱电解质,电离需要吸热(或生成的盐会水解,要吸收热量等).
=3.2℃,溶液的质量为:100ml×1g/ml=100g,则该反应中放出的热量为:Q=mc△T=100g×4.18J/(g℃)×3.2℃=1340J,即1.34kJ,所以答案是:1.34 kJ;(5)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,所以答案是:NH3H2O是弱电解质,电离需要吸热(或生成的盐会水解,要吸收热量等).


科目:高中化学 来源: 题型:
【题目】在1LK2SO4和CuSO4的混合溶液中,C(SO42﹣)=2molL﹣1 , 用石墨作电极电解该溶液,当通电一段时间后,两极均收集到22.4L(标况)气体,则原溶液中k+的物质的量浓度为( )
A.2molL﹣1
B.3 molL﹣1
C.1molL﹣1
D.0.5 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产、生活中应用广泛,用所学知识回答问题:
(1)重铬酸铵[(NH4)2Cr2O7]受热发生氧化还原反应,下列各组重铬酸铵受热分解产物的判断符合实际的是
A.CrO3+NH3+H2O
B.Cr2O3+NH3+H2O
C.CrO3+N2+H2O
D.Cr2O3+N2+H2O
(2)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3 , KMnO4被还原成Mn2+ , 该反应的离子方程式为
(3)KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯.其变化可表述为:2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O.
a.请分析该反应中电子转移的情况(单线桥法表示): .
b.还原剂与还原产物的物质的量之比为 .
c.浓盐酸在反应中显示出来的性质是 . (填写编号)
①只有还原性;②还原性和酸性;③只有氧化性;④氧化性和酸性.
d.产生0.1mol Cl2 , 则转移的电子的物质的量为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,下列各组热化学方程式中,△H2>△H1的是( )
A.H2 (g)+Cl2(g)═2HCl(g);△H1 ![]() H2(g)+
H2(g)+ ![]() Cl2(g)═HCl(g);△H2
Cl2(g)═HCl(g);△H2
B.2H2(g)+O2 (g)═2H2O(g);△H1 2H2 (g)+O2 (g)═2H2O(l);△H2
C.CO(g)+ ![]() O2(g)═CO2(g);△H1 2CO(g)+O2(g)═2CO2(g);△H2
O2(g)═CO2(g);△H1 2CO(g)+O2(g)═2CO2(g);△H2
D.S(s)+O2(g)═SO2 (g);△H1 S(g)+O2(g)═SO2 (g);△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热. 
起始温度t1/℃ | 终止温度t2/℃ | 温度差 | |||
HCl | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(1)在该实验中,量取50mL盐酸或NaOH溶液,需要用到的玻璃仪是;
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是;
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指温度;
(4)计算该实验发生中和反应时放出的热量为kJ[中和后生成的溶液的比热容c=4.18J(g℃)﹣1 , 稀溶液的密度都为1gcm﹣3];
(5)如果用50mL 0.55mol/L的氨水(NH3H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列实验所需的装置或仪器都正确的是( )
A.分离植物油和氯化钠溶液: 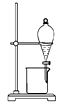
B.除去氯化钠晶体中混有的I2晶体: 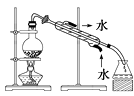
C.分离CCl4中的Br2: 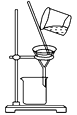
D.除去CO2气体中的HCl气体: 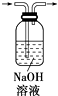
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中所含原子个数由多到少的顺序正确的是
①0.5mol的氯气②标准状况下22.4L氢气③4℃时9mL的水④0.2mol的磷酸
A. ①④③② B. ④③②① C. ②④③① D. ①④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH=5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的Cl原子和被还原的Cl原子的物质的量之比为5∶1
C.Cl2既做氧化剂又做还原剂
D.氧化剂得电子数与还原剂失电子数之比为5∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com