
分析 根据公式c=$\frac{1000ρω}{M}$计算稀释前溶质的物质的量浓度,根据稀释前后硫酸钾溶液的溶质物质的量不变,计算出稀释后硫酸钾的物质的量浓度.
解答 解:稀释前溶质的物质的量浓度为:c=$\frac{1000×1.08×\frac{11.1}{100+11.1}}{174}$mol/L=0.62mol/L,
稀释前后硫酸钾溶液的溶质物质的量不变,设:稀释后的浓度是x,则:0.62mol/L×0.35L=0.5x,
解得:x≈0.434mol/L,
答:稀释后溶液中K2SO4的物质的量浓度是0.434mol/L.
点评 本题考查物质的量浓度的计算,题目难度中等,解答关键是对计算公式理解,注意熟练掌握物质的量浓度的概念及计算方法,试题培养了学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
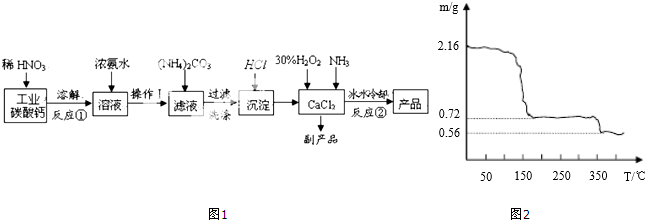
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
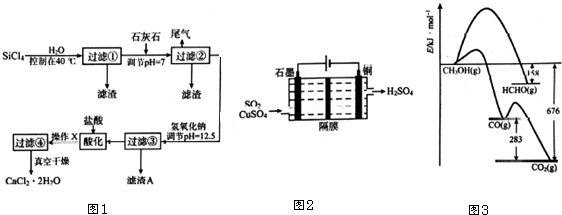
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2SiO3<H3PO4<H2SO4 | B. | 电负性:I>Cl>Br>F | ||
| C. | 第一电离能:N>O>C | D. | 沸点:H2O>H2Te>H2Se>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH>7,且 c(OH-)>c(Na+)>c(H+)>c(CH3COO-) | B. | pH>7,且 c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | ||
| C. | pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | D. | pH=7,且c(CH3COO-)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于Ksp(Ag2S)<Ksp(AgI),向含浓度分别为0.01mol/L的S2-与I-的混合溶液中加入足量的AgNO3(s),只有Ag2S沉淀生成 | |
| B. | FeS在水中的溶解度大于在Na2S溶液中的 | |
| C. | 向含有AgCl(s)的饱和AgCl溶液中加水,固体AgCl质量会减少,但AgCl的溶解度与Ksp均不变 | |
| D. | 达到沉淀溶解平衡时,溶液中离子浓度不一定相等但会保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com