
2SO2(g)+O2(g)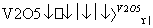 2SO3(g)是制备硫酸的重要反应,下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应,下列叙述正确的是( )
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=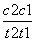
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
下列实验中,颜色有明显变化的是( )
|
| A. | 淀粉溶液中加入碘化钾溶液 |
|
| B. | 鸡蛋清中加入浓硝酸 |
|
| C. | 淀粉溶液中加入碘酒 |
|
| D. | 葡萄糖溶液与新制氢氧化铜浊液混合加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
要检验某溴乙烷中的溴元素,正确的实验方法是( )
|
| A. | 加入溴水振荡,观察水层是否有棕红色出现 |
|
| B. | 滴入AgNO3溶液,再加入稀硝酸呈酸性,观察有无浅黄色沉淀生成 |
|
| C. | 加入NaOH溶液共热,然后取上层清夜,加入稀硝酸呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 |
|
| D. | 加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
请根据实验内容,回答问题:
(1)实验室制取乙炔的反应方程式为 ,为除去乙炔中的H2S、PH3,把生成的气体通入 溶液中(填化学式),把乙炔通入溴水中,现象为 ,所得有机产物的名称为 .
(2)含有杂质的工业乙醇的蒸馏装置中,玻璃仪器有酒精灯、蒸馏烧瓶、 、 、牛角管、锥形瓶.
(3)除去苯甲酸晶体中的不溶性杂质,实验步骤为:加热溶解,蒸发浓缩, , ,过滤, ,干燥.
(4)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物,下列框图是分离操作步骤流程图:
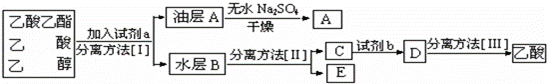
则试剂a是: ,分离方法Ⅰ是 ,分离方法Ⅱ是 ,试剂b是 ,分离方法Ⅲ是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应:A2+3B22AB3,以下表示的反应速率中,反应速率最快的是( )
A.v(A2)=0.4 mol·(L·min)-1
B.v(B2)=0.8 mol·(L·min)-1
C.v(AB3)=0.6 mol·(L·min)-1
D.v(A2)=0.01 mol·(L·s)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列物质的名称分别是
| 名称 | 硫代硫酸钠 | 多硫化钙 | 过氧化钡 | 超氧化钾 |
| 化学式 | Na2S2O3 | CaSx | BaO2 | KO2 |
根据上述命名规律回答:K2CS3应命名为
A.三硫代碳酸钾 B.多硫碳酸钾 C.过硫碳酸钾 D.超硫碳酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
2014 年 3 月 21 日是第二十二届“世界水日”,保护水资源,从我做起!
(1)ClO2和Cl2(还原产物都为Cl-)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的____________倍。
2)某无色废水中可能含有 Fe3+、Al3+、Mg2+、Na+、NO-、CO32-、SO42-离子中的几种,为分析其成分,分别取废水样品 100 mL,进行了三组实验,其操作和有关现象如下图所示:
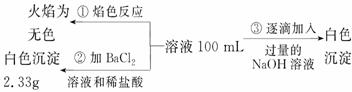
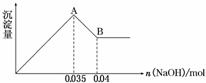
请根据上图回答下列问题:
①实验中需配制 1.0 mol/L的NaOH溶液100 mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管, 还缺少的仪器为_________。
②实验③中沉淀量由 A→B过程中所发生反应的离子方程式为__________。
③试确定NO3-是否存在?_______(填“存在”、“不存在”或“不确定”),若存在,试计算 c(NO3-)=____________(若不存在,此问不必作答)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com