
| A. | 6.2 g | B. | 8.8 g | C. | 8.0 g | D. | 11.2 g |
分析 使Na2O2固体增重5.6 g,发生反应2Na2O2+2CO2═2Na2CO3+O2;含碳元素的物质完全燃烧后再通入足量Na2O2固体,实际增加的为与CO2等物质的量的CO的质量;含氢的物质完全燃烧后再通入足量Na2O2固体,实际增加的为H原子的质量,以此来解答.
解答 解:混合气体直接通入到足量的Na2O2固体中,充分反应后,使Na2O2固体增重5.6 g,发生反应2Na2O2+2CO2═2Na2CO3+O2,
2Na2O2+2CO2═2Na2CO3+O2 △m
88 32 56
x 5.6g
可知参加反应的CO2的质量为$\frac{5.6g}{56}×88$=8.8 g,所以CH4O、CO的质量之和为11.2-8.8=2.4 g;
第二次经过燃烧后使Na2O2固体增重的反应过程中,根据反应方程式得到规律:含碳元素的物质完全燃烧后再通入足量Na2O2固体,实际增加的为与CO2等物质的量的CO的质量;含氢的物质完全燃烧后再通入足量Na2O2固体,实际增加的为H原子的质量,
则CH4O、CO的质量之和就是使Na2O2固体增加的质量,再加上CO2使Na2O2固体增重的5.6 g,即2.4g+5.6g=8.0 g,
故选C.
点评 本题考查化学反应方程式的计算,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与计算能力的考查,注意固体增重的判断,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
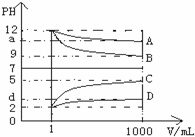
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜及其化合物在科学研究和工业生产中具有许多用途.
铜及其化合物在科学研究和工业生产中具有许多用途. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
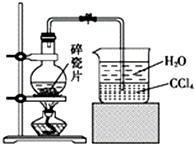 1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.
1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.| 反应物 | NaBr | 98.3% 浓H2SO4 | 异戊醇 | 水 |
| 用量 | 0.30mol | 35mL(过量) | 0.25mol | 30mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点,/℃ | 溶解度/l00g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
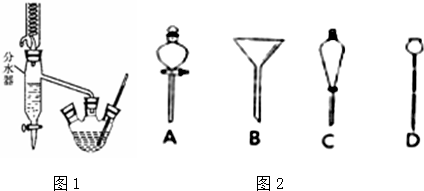
 CH3COOCH2CH2CH2CH3+H2O.
CH3COOCH2CH2CH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaClO溶液中通入过量SO2:ClO-+SO2+H2O═HClO+HSO3- | |
| B. | Na2S投入水中:S2-+2H2O?H2S+2OH- | |
| C. | 向含1molAlCl3溶液中投入4molNa:Al3++4Na+2H2O═AlO2-+4Na++2H2↑ | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4、C2H6O | B. | C2H2、C6H6 | C. | CH2O、C3H6O2 | D. | CH4、C2H4O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com