
| A. | $\frac{1}{2}$N2H4(g)+$\frac{1}{2}$O2(g)═$\frac{1}{2}$N2(g)+H2O(l)△H=-267 kJ•mol-1 | |
| B. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-133.5 kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=+534 kJ•mol-1 | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534 kJ•mol-1 |
分析 0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,可知1molN2H4(g)完全燃烧生成氮气和气态水时,放出热量为$\frac{133.5kJ}{0.25}$=534kJ,焓变为负,结合热化学方程式中物质状态、n与热量成正比及焓变来解答.
解答 解:0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,可知1molN2H4(g)完全燃烧生成氮气和气态水时,放出热量为$\frac{133.5kJ}{0.25}$=534kJ,焓变为负,则热化学方程式为N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-534 kJ•mol-1,
0.5mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ×2=267kJ热量,热化学方程式为$\frac{1}{2}$N2H4(g)+$\frac{1}{2}$O2(g)═$\frac{1}{2}$N2(g)+H2O(l)△H=-267 kJ•mol-1,
故选A.
点评 本题考查热化学方程式的书写,为高频考点,把握热化学方程式的书写方法、物质的量与热量的关系为解答的关键,侧重分析与应用能力的考查,注意焓变为负及水的状态,题目难度不大.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
从植物花汁中提取的一种有机HIn,可做酸碱指示剂,在水溶液中存在电离平衡:HIn(红色)  H++In-(黄色),对上述平衡解释不正确的是
H++In-(黄色),对上述平衡解释不正确的是
A.升高温度平衡向正方向移动
B.加入盐酸后平衡向逆方向移动,溶液显红色
C.加入NaOH溶液后平衡向正方向移动,溶液显黄色
D.加入NaHSO4溶液后平衡向正方向移动,溶液显黄色
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
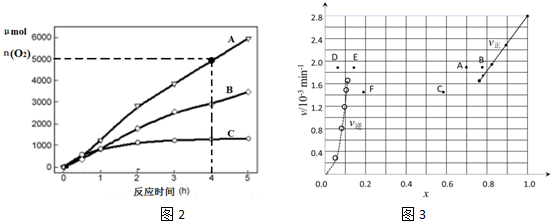
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔融NaHSO4电离出的阳离子与阴离子之比 | |
| B. | 0.2mol•L-1的CH3COOH溶液与0.1mol•L-1的盐酸中c(H+)之比 | |
| C. | pH=7的氨水与(NH4)2SO4的混合溶液中,c(NH4+)与c(SO42-)之比 | |
| D. | pH=12的Ba(OH)2溶液与pH=12的KOH溶液中c(OH-)之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com