
| A£® | 1mol¹ĢĢ¬ĪļÖŹ»ņŅŗĢ¬ĪļÖŹµÄĢå»żÖ÷ŅŖ¾ö¶ØÓŚ¹¹³ÉÕāÖÖĪļÖŹµÄĮ£×ӵēóŠ”ŗĶĮ£×ÓŹżÄæ | |
| B£® | ŌŚĻąĶ¬ĪĀ¶ČŗĶŃ¹ĒæĻĀ£¬ČĪŗĪĘųĢåĮ£×ÓÖ®¼äµÄ¾ąĄėæÉ擳ÉĻąµČµÄ | |
| C£® | ÅäÖĘŅ»¶ØĪļÖŹµÄĮæÅØ¶ČµÄĮņĖįČÜŅŗŹ±£¬ÓĆĮæĶ²ĮæČ”Ņ»¶ØĢå»żµÄÅØĮņĖįµ¹ČėÉÕ±ŗó£¬ŌŁÓĆÕōĮóĖ®Ļ“µÓĮæĶ²2”«3“Ī£¬²¢½«Ļ“µÓŅŗŅ»²¢µ¹ČėÉÕ±ÖŠĻ”ŹĶ | |
| D£® | ĪŖÓėČŻĮæĘæµÄ¾«¶ČĻąĘ„Åä³ĘĮæ¹ĢĢåÖŹĮæŹ±²»Ó¦ÓĆĶŠÅĢĢģĘ½ |
·ÖĪö A£®¹ĢĢ¬ĪļÖŹ»ņŅŗĢ¬ĪļÖŹµÄĢå»żÓėĮ£×ӵēóŠ”ŗĶĮ£×ÓŹżÄæÓŠ¹Ų£»
B£®ĻąĶ¬ĪĀ¶ČŗĶŃ¹ĒæĻĀ£¬VmĻąĶ¬£¬Ģå»żÓėĪ¢Į£ŹżÄæÓŠ¹Ų£»
C£®ŌŚÉÕ±ÖŠĻ”ŹĶĄäČ“ŗó×ŖŅĘ£¬ĮæĶ²²»ŠčŅŖĻ“µÓ£»
D£®ÅäÖĘŅ»¶ØÅØ¶ČµÄČÜŅŗ£¬ĄūÓĆĢģĘ½³ĘĮæ¹ĢĢåÖŹĮ森
½ā“š ½ā£ŗA£®¹ĢĢ¬ĪļÖŹ»ņŅŗĢ¬ĪļÖŹµÄĢå»żÓėĮ£×ӵēóŠ”ŗĶĮ£×ÓŹżÄæÓŠ¹Ų£¬Ōņ1mol¹ĢĢ¬ĪļÖŹ»ņŅŗĢ¬ĪļÖŹµÄĢå»żÖ÷ŅŖ¾ö¶ØÓŚ¹¹³ÉÕāÖÖĪļÖŹµÄĮ£×ӵē󊔣¬¹ŹA“ķĪó£»
B£®ĻąĶ¬ĪĀ¶ČŗĶŃ¹ĒæĻĀ£¬VmĻąĶ¬£¬Ģå»żÓėĪ¢Į£ŹżÄæÓŠ¹Ų£¬ŌņČĪŗĪĘųĢåĮ£×ÓÖ®¼äµÄ¾ąĄėæÉ擳ÉĻąµČµÄ£¬¹ŹBÕżČ·£»
C£®ŌŚÉÕ±ÖŠĻ”ŹĶĄäČ“ŗó×ŖŅĘ£¬ĮæĶ²²»ŠčŅŖĻ“µÓ£¬Ļ“µÓÉÕ±2”«3“Ī£¬¹ŹC“ķĪó£»
D£®ÅäÖĘŅ»¶ØÅØ¶ČµÄČÜŅŗ£¬ĄūÓĆĢģĘ½³ĘĮæ¹ĢĢåÖŹĮæ£¬ČŻĮæĘ攢ĶŠÅĢĢģĘ½¾łĪŖÅäÖĘČÜŅŗŠčŅŖµÄŅĒĘ÷£¬¹ŹD“ķĪó£»
¹ŹŃ”B£®
µćĘĄ ±¾Ģāæ¼²é»ÆѧŹµŃé·½°øµÄĘĄ¼Ū£¬ĪŖøßĘµæ¼µć£¬°ŃĪÕĪļÖŹµÄĮæµÄ¼ĘĖć”¢ČÜŅŗµÄÅäÖĘĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓėŹµŃéÄÜĮ¦µÄ漲飬עŅāŹµŃéµÄĘĄ¼ŪŠŌ·ÖĪö£¬ĢāÄæÄŃ¶Č²»“ó£®


 ŠĀ»īĮ¦×ܶÆŌ±ŹīĻµĮŠ“š°ø
ŠĀ»īĮ¦×ܶÆŌ±ŹīĻµĮŠ“š°ø ĮśČĖĶ¼ŹéæģĄÖ¼ŁĘŚŹī¼Ł×÷ŅµÖ£ÖŻ“óѧ³ö°ęÉēĻµĮŠ“š°ø
ĮśČĖĶ¼ŹéæģĄÖ¼ŁĘŚŹī¼Ł×÷ŅµÖ£ÖŻ“óѧ³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
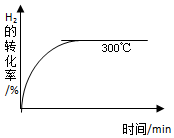 ¼×“¼ŹĒŅ»ÖÖæÉŌŁÉśÄÜŌ“£¬¾ßÓŠæŖ·¢ŗĶÓ¦ÓĆµÄ¹ćĄ«Ē°¾°£¬¹¤ŅµÉĻŅ»°ćæɲÉÓĆČēĻĀ·“Ó¦Ą“ŗĻ³É¼×“¼£ŗ2H2£Øg£©+CO£Øg£©?CH3OH£Øg£©
¼×“¼ŹĒŅ»ÖÖæÉŌŁÉśÄÜŌ“£¬¾ßÓŠæŖ·¢ŗĶÓ¦ÓĆµÄ¹ćĄ«Ē°¾°£¬¹¤ŅµÉĻŅ»°ćæɲÉÓĆČēĻĀ·“Ó¦Ą“ŗĻ³É¼×“¼£ŗ2H2£Øg£©+CO£Øg£©?CH3OH£Øg£©| ĪĀ¶Č | 250”ę | 300”ę | 350”ę |
| K | 2.041 | 0.270 | 0.012 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.1 mol/L NaBČÜŅŗÖŠĖ®µēĄėµÄOH-ÅØ¶Č“óÓŚ10-7 mol/L | |
| B£® | NaBČÜŅŗÖŠ£ŗc£ØNa+£©£¾c£ØB-£©£¾c£ØH+£©£¾c£ØOH-£© | |
| C£® | NaBČÜŅŗÖŠ£ŗc£ØNa+£©+c£ØH+£©=c£ØHB£©+c£ØB-£© | |
| D£® | HBµÄµēĄė·½³ĢŹ½ĪŖ£ŗHBØTH++B- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÄĘ”¢Ć¾µČ½šŹō×Å»š£¬²»æÉÓĆCO2Ćš»š | |
| B£® | ŌŚĘųĢå·¢Éś×°ÖĆÉĻµćČ¼ĒāĘųµČĘųĢåŹ±£¬±ŲŠėĻČ¼ģŃéĘųĢåµÄ“æ¶Č | |
| C£® | ŹµŃé½įŹųŗó½«ĖłÓŠµÄ·ĻŅŗµ¹ČėĻĀĖ®µĄÅųöŹµŃéŹŅ£¬ŅŌĆāĪŪČ¾ŹµŃéŹŅ | |
| D£® | øųŹŌ¹ÜÖŠµÄŅŗĢå¼ÓČČŹ±£¬²»Ķ£ŃŲŹŌ¹ÜĒ抱·½ĻņŅĘ¶ÆŹŌ¹Ü»ņ¼ÓČėĖé“Éʬ£¬ŅŌĆāŅŗĢ屩·ŠÉĖČĖ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĀČĘųÄÜÓė“󶹏ż½šŹō»ÆŗĻ£¬ĘäŅ»°ć½«±ä¼Ū½šŹōŃõ»ÆÖĮ×īøß¼Ū | |
| B£® | øÉŌļµÄĀČĘųŗĶĀČĖ®¾łÄÜŹ¹ĻŹ»ØĶŹÉ« | |
| C£® | ³żČ„ĀČĘųÖŠÉŁĮæĀČ»ÆĒāæÉŹ¹ĘųĢåĶعż±„ŗĶŹ³ŃĪĖ® | |
| D£® | ŅņĪŖĀČĘųÓŠ¶¾£¬ĖłŅŌæÉÓĆӌɱ¾ś”¢Ļū¶¾”¢ĘÆ°× |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 32gŃõĘųŗĶ³ōŃõ»ģŗĻĪļÖŠŃõŌ×ÓµÄĪļÖŹµÄĮæĪŖ2 mol | |
| B£® | 2molµÄĮņĖįµÄĦ¶ūÖŹĮæĪŖ196g/mol | |
| C£® | Ņ»¶ØĪĀ¶ČŗĶŃ¹ĒæĻĀ£¬ø÷ÖÖĘųĢ¬ĪļÖŹµÄĢå»żÓɹ¹³ÉĘųĢå·Ö×ӵē󊔾ö¶Ø | |
| D£® | ½«58.5gNaClČÜÓŚ941.5gĖ®ÖŠÅä³É1mol/LµÄNaClČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | NaXČÜŅŗµÄpH£¾7£¬ŌņæÉÖ¤Ć÷HXŹōÓŚČõµē½āÖŹ | |
| B£® | ¶žĀČ»ÆĢśČÜŅŗæÉŅŌ×öµē×Ó¹¤ŅµÖŠĶ°ęµÄæĢŹ“Ņŗ | |
| C£® | ŹµŃéŹŅŹ¢·ÅNaFČÜŅŗ²»ÄÜÓĆ²£Į§²ÄÖŹµÄŹŌ¼ĮĘæ¼°²£Į§Čū | |
| D£® | ÅصÄĮņ»ÆÄĘČÜŅŗÓŠĒæĮŅµÄ³ōĪ¶ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
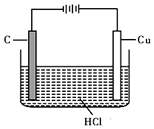 ŃĪĖį”¢ĮņĖįŗĶĻõĖįŹĒ֊ѧ³£¼ūµÄČżÖÖĖį£®
ŃĪĖį”¢ĮņĖįŗĶĻõĖįŹĒ֊ѧ³£¼ūµÄČżÖÖĖį£®²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com