
下列实验报告记录的实验现象正确的是( )
| 实验 |
| ||||
| 记录 | A | 无色 | 无色 | 无现象 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 无色溶液 | |
| C | 红色 | 无色 | 无色溶液 | 白色沉淀 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 |
|
| A. | A | B. | B | C. | C | D. | D |
| 二氧化硫的化学性质.. | |
| 专题: | 氧族元素. |
| 分析: | 二氧化硫的水溶液为酸的溶液,能使石蕊变红;二氧化硫具有漂白性,能使品红褪色;氯水与二氧化硫发生氧化还原反应,再与氯化钡溶液反应;二氧化硫与碘水发生氧化还原反应,以此来解答. |
| 解答: | 解:A、由二氧化硫的水溶液为酸的溶液,能使石蕊变红; B、二氧化硫具有漂白性,能使品红褪色; C、氯水与二氧化硫发生氧化还原反应,再与氯化钡溶液反应生成硫酸钡白色沉淀; D、二氧化硫与碘水发生氧化还原反应生成HI和硫酸,溶液为无色, 则现象分别为红色、无色、白色沉淀、无色, 故选B. |
| 点评: | 本题考查二氧化硫的性质,熟悉发生的化学反应是解答本题的关键,注意二氧化硫与氯水溶液反应是学生解答的难点,题目难度不大. |


科目:高中化学 来源: 题型:
下列变化一定属于化学变化的是
①风化 ②变色 ③燃烧 ④爆炸 ⑤白磷转变成红磷 ⑥工业制氧气 ⑦久置氯水变成无色 ⑧分馏 ⑨NO2气体冷却后颜色变浅 ⑩潮解
A.①②③④⑦ B.③④⑤⑦ C.①③④⑦⑩ D.①③⑤⑦⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
将固体NH4Br置于密闭容器中,在某温度下,发生下列反应:NH4Br(s)═NH3(g)+HBr(g),2HBr(g)fBr2(g)+H2(g).两分钟后,反应达到化学平衡,测知H2浓度为0.5mol•L﹣1,HBr的浓度为4mol•L﹣1,若上述反应速率用v(NH3)表示,下列速率正确的是( )
|
| A. | 0.5 mol•L﹣1•min﹣1 | B. | 2.5 mol•L﹣1•min﹣1 |
|
| C. | 2 mol•L﹣1•min﹣1 | D. | 5 mol•L﹣1•min﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
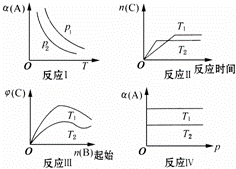
某化学科研小组研究在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g)⇌cC(g)表示]化学平衡的影响,得到如图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,φ表示体积分数):
分析图象,回答下列问题:
(1)在图象反应Ⅰ中,若p1>p2,则此正反应为 (填“吸热”或“放热”)反应,也是一个气体分子数 (填“减少”或“增大”)的反应,由此判断,此反应自发进行,必须满足的条件是 .
(2)在图象反应Ⅱ中,T1 < T2(填“>”、“<”或“=”),该正反应为 (填“吸热”或“放热”)反应.
(3)在图象反应Ⅲ中,若T2>T1,则此正反应为 (填“吸热”或“放热”)反应.
(4)在图象反应Ⅳ中,若T1>T2,则该反应能否自发进行?
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是( )
|
| A. | 漂白粉露置在空气中失效:ClO﹣+CO2+H2O=HClO+HCO3﹣ |
|
| B. | 向NaAlO2溶液中通入过量CO2:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣ |
|
| C. | 向Na2S2O3溶液中通入足量氯气:S2O32﹣+2Cl2+3H2O=2SO32﹣+4Cl﹣+6H+ |
|
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO﹣+Fe(OH)3=FeO42﹣+3Cl﹣+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
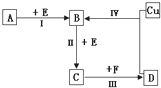
有两种位于短周期的相邻周期、相邻主族的非金属元素X、Y,已知两元素最高价氧化物的水化物均为强酸.根据下图转化关系(反应条件及部分产物已略去),回答下列问题:
(1)若A、B、C、D均为含X元素的化合物,且A、F的一个分子中都只含有10个电子,则:
①A分子的空间构型为 三角锥形 ,F分子的电子式为 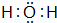 .
.
②反应 I 的化学方程式为 4NH3+5O2 4NO+6H2O .
4NO+6H2O .
③化合物NaX3是合成“达菲”的中间活性物质,也是汽车安全气囊中的主要物质.NaX3受撞击后生成Na3X和另一种气体单质,请写出该反应的化学方程式 3NaN3=Na3N+4N2↑ .
④X的氧化物是形成光化学烟雾原因之一,工业上可采用它与其氢化物反应生成无毒害物质而除去,请用方程式表示该反应 6NOx+4xNH3=(3+2x)N2+6xH2O .
(2)若A、B、C、D均为含Y元素的化合物,其中A由两种元素组成,且A的摩尔质量为120g•mol﹣1,则:
①将反应IV所得的溶液加热蒸干得到的晶体属于 离子 晶体(填“离子”、“分子”、“原子”)
②反应 I 的化学方程式为 4FeS2+11O2 2Fe2O3+8SO2 .
2Fe2O3+8SO2 .
③含Y元素的化合物Na2Y和次氯酸钠溶液在强碱性环境中能发生反应,产物无沉淀,请写出该反应的离子反应方程式 S2﹣+4ClO﹣=SO42﹣+4Cl﹣ .
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
|
| A. | 1.0mol•L﹣1的KNO3溶液:H+、Fe2+、Cl﹣、SO42﹣ |
|
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2﹣、Cl﹣ |
|
| C. | c(H+)=10﹣12mol•L﹣1的溶液:K+、Ba2+、Cl﹣、Br﹣ |
|
| D. | 加入苯酚显紫色的溶液:K+、NH4+、Cl﹣、I﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某同学开展了题为“醋酸是弱电解质的实验探究”的探究活动。该同学设计了如下方案,其中错误的是( )
A.先配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质
B.先配制一定量0.01 mol/L和0.10 mol/L 的CH3COOH溶液,分别用pH计测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质
C.先测0.10 mol/L CH3COOH溶液的pH,然后将其加热至100℃,再测pH,如果pH变小,则可证明醋酸是弱电解质
D.配制一定量的CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使甲基橙变红色的溶液:Mg2+、K+、SO 、NO
、NO
B.使酚酞变红色的溶液:Na+、Cu2+、HCO 、NO
、NO
C.0. 1 mol·L-1AgNO3 溶液:H+、K+、SO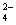 、I-
、I-
D.0. 1 mol·L-1NaAlO2 溶液: H+、Na+、Cl-、SO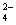
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com