
 苯甲酸乙酯是一种无色透明液体、能与乙醇、乙醚混溶,不溶于水.用于配制香水香精和人造精油,其制备原理如下:
苯甲酸乙酯是一种无色透明液体、能与乙醇、乙醚混溶,不溶于水.用于配制香水香精和人造精油,其制备原理如下: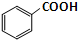 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$ +H2O
+H2O| 物质 | 颜色状态 | 密度/g•cm-3 | 熔点/℃ | 沸点/℃ |
| 苯甲酸* | 白色固体 | 1.2659 | 122 | 249 |
| 苯甲酸乙酯 | 无色液体 | 1.05 | -34.6 | 212.6 |
| 乙酸 | 无色液体 | 1.0492 | 16.6 | 117.9 |
| 乙醇 | 无色液体 | 0.789 | -117.3 | 78.5 |
| 乙酸乙酯 | 无色液体 | 0.894-0.898 | -83.6 | 77.1 |
| 乙醚 | 无色液体 | 0.713 | -116.3 | 34.6 |
分析 (1)①与酸混合时,将密度大的液体注入密度小的液体中,混合浓硫酸和乙醇时,应将浓硫酸慢慢注入到乙醇中,并不断搅拌,使产生的热量及时散失;
②乙酸与乙醇需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;
③随着乙酸乙酯的蒸出,红色会变浅,但是无气体产生,是因为碳酸钠与醋酸反应生成碳酸氢根离子,酸性减弱;
(2)①a.使用分水器不断分离除去水,促进反应正向进行,生成酯的产率增大;
b.依据装置中反应物挥发出,反应物减小导致反应物的利用率降低分析;
c.根据分流漏斗的使用方法可知,下层液体从下口放出,上层液体从上层倒出,苯甲酸乙酯的密度小于水,据此判断;
d.实验的产率=$\frac{实际产量}{理论产量}$×100%;
e.若加入的Na2CO3溶液不足,在之后的蒸馏时烧瓶内会出现的白烟是固体小颗粒,可能是苯甲酸乙酯中混有未除净的苯甲酸.
解答 解:(1)①浓硫酸溶于水放出大量的热,乙醇中含有少量水,应将浓硫酸加入到乙醇中,防止硫酸溶解时放出大量的热导致液体飞溅,则加入药品的顺序为先在大试管中注入乙醇,再分别缓缓加入浓硫酸和乙酸(乙酸和浓硫酸的加入顺序可互换),边加边振荡试管使之混合均匀,即加入顺序为乙醇、浓硫酸、乙酸(乙酸和浓硫酸的加入顺序可互换),
故答案为:乙醇、浓硫酸、乙酸(乙酸和浓硫酸的加入顺序可互换);
②乙酸与乙醇需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动.故浓硫酸的作用为催化剂,吸水剂,
故答案为:催化剂、吸水剂;
③碳酸钠为强碱弱碱盐,碳酸根离子水解呈碱性,实验开始前在饱和碳酸钠加入酚酞,溶液会变红,随着乙酸乙酯的蒸出,发生反应:CH3COOH+CO32-=CH3COO-+HCO3-,碳酸根离子浓度减小,碱性减弱,所以红色会变浅,但是无气体产生,
故答案为:CH3COOH+CO32-=CH3COO-+HCO3-;
(2)①a.酯化反应是可逆反应,使用分水器不断分离除去水,促进酯化反应正反应方向进行,提高生成酯的产量,
故答案为:分离反应过程中生的水,促进酯化反应向正反应方向进行;
b.如果使用制取乙酸乙酯的装置,反应过程中加热,会使乙醇大量蒸馏出去,乙醇挥发混入酯中,降低反应物的利用率,实验效率大大降低,
故答案为:如果使用制取乙酸乙酯的装置,会使乙醇大量蒸馏出去,实验效率大大降低;
c.分流漏斗,下层液体从下口放出,上层液体从上层倒出,苯甲酸乙酯的密度小于水,所以有机层从下口放出,
故答案为:上口倒出;
d.12.20g苯甲酸的物质的量为:n=$\frac{m}{M}$=$\frac{12.20g}{122g/mol}$=0.1mol,理论生成的苯甲酸乙酯的质量为0.1×150g=15g,而实际生成苯甲酸乙酯的质量为:6mL×1.05g•ml-1=6.3g,所以实验的产率=$\frac{6.3g}{15g}$×100%=42%,
故答案为:42%;
e.加入Na2CO3能与未反应的苯甲酸和硫酸,可以除去未反应的苯甲酸和硫酸,白烟是固体小颗粒,因为苯甲酸在100℃会迅速升华,所以可能是苯甲酸乙酯中混有未除净的苯甲酸,
故答案为:在苯甲酸乙酯中有未除尽的苯甲酸,受热至100℃时升华.
点评 本题考查了物质制备方案的设计,题目难度中等,明确制备原理为解答关键,试题涉及酯化反应原理、化学实验基本操作方法、产率的计算、化学平衡的影响因素等知识,注意掌握物质制备方案的设计及评价原则,试题充分考查了学生的分析能力及灵活应用基础知识的能力.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:解答题
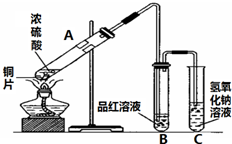 图是进行铜与浓硫酸反应并进行产物检验的装置.
图是进行铜与浓硫酸反应并进行产物检验的装置.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
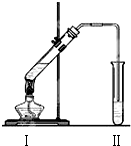 图是实验室制乙酸乙酯的装置.
图是实验室制乙酸乙酯的装置.| 实验 编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol•L-1浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 饱和Na2CO3溶液 | 0.1 |
| C | 3mL乙醇、2mL乙酸、6mL3mol•L-1硫酸 | 饱和Na2CO3溶液 | 1.2 |
| D | 3mL乙醇、2mL乙酸、6mL6mol•L-1盐酸 | 饱和Na2CO3溶液 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
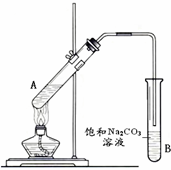 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
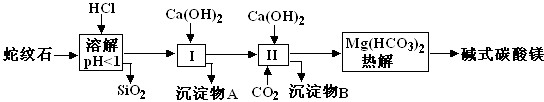
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.3 | 3.3 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A是固体,C是气体,正反应吸热 | B. | A是气体,C是气体,正反应放热 | ||
| C. | A是气体,C是固体,正反应放热 | D. | A是气体,C是气体,正反应吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
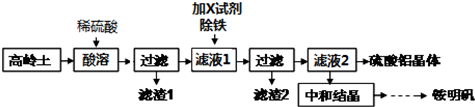
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
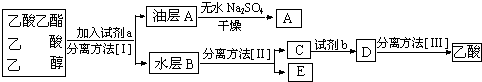
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 相对分子质量M=$\frac{22.4mw}{(1-w)V}$ | B. | 物质的量浓度c=$\frac{1000ρv}{Mv+22.4}$ | ||
| C. | 质量分数w=$\frac{Mv}{22.4m}$ | D. | 溶液密度ρ=$\frac{cM}{1000w}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com