
金属冶炼和处理常涉及电化学反应。
(1)冶炼或冶炼提纯下列相应金属时没有采用到电解法的是
a.Fe b.Na c.Cu d.Al
(2)右图为电解精炼银的示意图, (填a或b)极为含有杂质的粗银;电解过程中,若b极伴有少量无色气体生成,在空气中变红棕色,则生成气体的电极反应式为____________________

(3)银白光亮的银器用久后表面易出现黑斑(Ag2S),为处理黑斑,将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 。
(4)右图的装置进行电解实验:A极是铜锌合金,B极为纯铜,电解质为CuSO4溶液(足量)。通电一定时间后,A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.03g ,则A合金中Cu、Zn原子个数比为 。

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源:2015-2016学年福建省高二上学期半期考试化学试卷(解析版) 题型:推断题
下列是以烃A为原料合成可降解高聚物C和抗氧化剂I的合成路线。
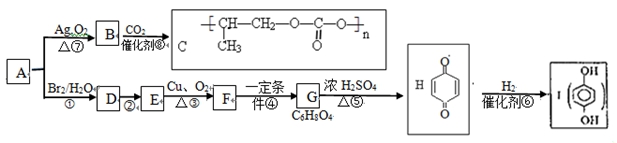

(1)烃A的最大质荷比为42.则A的分子式为 ;D→E的试剂及反应条件为 。
(2)B中有一个三元环,B的结构简式为 ;⑤的反应类型是 。
(3)Ⅰ可作抗氧剂,原因是 。
(4)写出下列反应方程式:
①F与新制Cu(OH)2悬浊液反应 ;
②C为可降解材料,其在酸性条件下的水解反应
(5)写出满足下列条件的G的同分异构体:①属于酯;②核磁共振氢谱只有两种吸收峰;③无环;④不能发生银镜反应。 (任写两种)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上第一次月考化学试卷(解析版) 题型:实验题
某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒? (填“能”或“否”),其原因是 。
(3)他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50 mL 0.55 mol·L-1 NaOH溶液 | 50 mL 0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.3 ℃ | |
② | 50 mL 0.55 mol·L-1 NaOH溶液 | 50 mL 0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.5 ℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。根据该实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
(4)若用KOH代替NaOH,对测定结果 (填“有”或“无”)影响,若用冰醋酸代替HCl做实验,对测定结果 (填“有”或“无”)影响。
查看答案和解析>>
科目:高中化学 来源:2016届四川省成都市高三上学期期中考试理综化学试卷(解析版) 题型:选择题
已知K2Cr2O7溶液中存在如下平衡: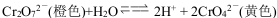 。
。
①向2mL 0.1mol·L K2Cr2O7溶液中滴入3滴6mol/L NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色;
②向酸化K2Cr2O7溶液中滴入适量Na2SO3溶液,溶液由橙色变为绿色:
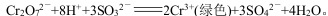
下列分析正确的是
A.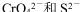 在酸性溶液中可大量共存
在酸性溶液中可大量共存
B.实验②说明氧化性: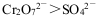
C.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小
D.实验①和②均能证明K2Cr2O7溶液中存在上述平衡
查看答案和解析>>
科目:高中化学 来源:2016届吉林省长春市高三上学期质量监测化学试卷(解析版) 题型:选择题
在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),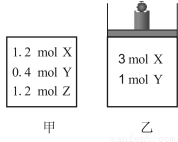
发生如下反应:3 X(g)+Y(g) 2 Z(g) ΔH<0,保持温度不变,测得平衡时的有关数据如下:
2 Z(g) ΔH<0,保持温度不变,测得平衡时的有关数据如下:
恒容容器甲 | 恒压容器乙 | |
Y的物质的量/mol | n1 | n2 |
Z的体积分数 | φ1 | φ2 |
下列说法正确的是
A.平衡时容器乙的容积一定比反应前大
B.平衡时容器甲的压强一定比反应前大
C.n2>n1
D.φ2>φ1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省四地六校高二上学期10月联考化学试卷(解析版) 题型:选择题
有a、b、c、d四个金属电极,G为电流计。有关的反应装置及部分反应现象如下:
实验 装置 |
|
|
|
|
部分实验现象 | a极质量减小b极质量增加 | 溶液中的SO42-向b极移动 | d极溶解c极有气体产生 | 电子从d极流向 a极 |
由此可判断这四种金属的活动性顺序是
A.d>a>b>c B. a>b>c>d C. b>c>d>a D. a>b>d>c
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上学期第一次段中考试化学试卷(解析版) 题型:选择题
同时对农作物施用含N、P、K的三种化肥,对给定的下列化肥:①K2CO3、②KCl、③Ca(H2PO4)2、④(NH4)2SO4,⑤氨水,最适当的组合是
A.①③④ B.①③⑤ C.②③④ D.②③⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期10月月考化学试卷(解析版) 题型:选择题
对已达化学平衡的反应:2X(g)+Y(g) 2Z(g),减小压强后,对反应产生的影响是
2Z(g),减小压强后,对反应产生的影响是
A. 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B. 逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C. 正反应速率先减小后增大,逆反应速率减小,平衡向逆反应方向移动
D. 逆反应速率先减小后增大,正反应速率减小,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省福安市高二上学期第一次月考化学试卷(解析版) 题型:填空题
(12分)金属铁是应用广泛,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法。实验中称取3.25g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用1.0 mol·L-1的盐酸中和滴定,正好中和时消耗盐酸60.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值:
(列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl) = 1∶2.8,则该样品中FeCl3的物质的量分数为 。
(3)把SO2气体通入FeCl3溶液中,发生反应的离子方程式为 。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 ;与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,其中Zn极的电极反应式为 ,K2FeO4的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com