

·ÖĪö ĄūÓĆĆ÷·ÆŹÆ£ØÖ÷ŅŖ³É·ÖŹĒK2SO4•Al2£ØSO4£©3•2Al2O3•6H2O£¬“ĖĶā»¹ŗ¬ÓŠÉŁĮæFe2O3ŌÓÖŹ£©ÖʱøAl2O3”¢K2FeO4ŗĶH2SO4µÄ¹¤ŅÕĮ÷³Ģ£ŗĆ÷·ÆĶŃĖ®ŗóÖ÷ŅŖ³É·ÖŹĒK2SO4•Al2£ØSO4£©3•2Al2O3£¬”°±ŗÉÕ”±Al2£ØSO4£©3ÖŠ+6¼Ū½µµĶĪŖSO2ÖŠ+4¼Ū£¬Al2£ØSO4£©3ŹĒŃõ»Æ¼Į£¬Įņµ„ÖŹĪŖ»¹Ō¼Į£¬·¢Éś2Al2£ØSO4£©3+3S$\frac{\underline{\;øßĪĀ\;}}{\;}$Al2O3+9SO2£¬ŹģĮĻČܽāĪŖŃõ»ÆĀĮÓėĒāŃõ»Æ¼ŲČÜŅŗ·“Ӧɜ³ÉĘ«ĀĮĖį¼Ų£¬Ąė×Ó·½³ĢŹ½ĪŖAl2O3+2OH-=2AlO2-+H2O£¬ŹģĮĻČܽāĖłµĆµÄČÜŅŗÖŠŗ¬ÓŠK+”¢SO42-”¢AlO2-”¢OH-µČ£¬¼ÓĮņĖįµ÷PHÖµ£¬AlO2-×Ŗ»ÆĪŖAl£ØOH£©3£¬×ĘÉÕÉś³ÉAl2O3£¬ÄøŅŗÖŠĄė×ÓÖ÷ŅŖÓŠK+”¢SO42-£¬ŗ¬ÓŠČÜÖŹĪŖK2SO4£¬ĀĖŌüĪŖFe2O3£¬¼ÓĮņĖįFe2O3+3H2SO4=Fe2£ØSO4£©3+3H2O£¬XĪŖFe2£ØSO4£©3£¬¼ÓĒāŃõ»Æ¼ŲFe2£ØSO4£©3+6KOH=2Fe£ØOH£©3”ż+3K2SO4£¬ĶØČėĀČĘų£ŗ2Fe£ØOH£©3+3Cl2+10KOHØT2K2FeO4+6KCl+8H2O£¬ÖʵĆK2FeO4£¬
£Ø1£©Ėłŗ¬ŌŖĖŲ»ÆŗĻ¼Ū½µµĶµÄ·“Ó¦ĪļŹĒŃõ»Æ¼Į£»·“Ó¦ÖŠĮņµ„ÖŹÖŠĮņŌŖĖŲ»ÆŗĻ¼ŪÓÉ0¼ŪÉżøßĪŖSO2ÖŠ+4¼Ū£¬Įņµ„ÖŹĪŖ»¹Ō¼Į£¬¼ĘĖćÉś³É102gAl2O3ŠčŅŖĮņµÄĪļÖŹµÄĮ棬×ŖŅʵē×ÓŹĒĮņµ„ÖŹµÄ4±¶£¬ŌŁøł¾ŻN=nNA×ŖŅʵē×ÓŹżÄ棻
£Ø2£©·ÖĪöĮ÷³Ģ½įŗĻŃõ»ÆĀĮµÄŠŌÖŹæÉÖŖ£¬³Įµķ¢ńŹĒAl£ØOH£©3£¬³ĮµķIIŹĒĒāŃõ»ÆĢś£»
£Ø3£©³Įµķ¢ńŹĒAl£ØOH£©3£¬Ö¤Ć÷³Įµķ¢ńŅŃĻ“µÓøɾ»µÄŹµŃé²Ł×÷ŹĒ¼ģŃéĻ“µÓŅŗÖŠŹ¦øµŗŗÓļĮņĖįøłĄė×ÓÉč¼ĘŹµŃé¼ģŃ飻
£Ø4£©“ÓĀĖŅŗÖŠµĆµ½K2SO4¾§ĢåµÄ·½·ØŹĒÕō·¢ÅØĖõ£¬ĄäČ“½į¾§£¬¹żĀĖĻ“µÓµĆµ½¾§Ģ壻
£Ø5£©“ÓĮņĖį¼ŲČÜŅŗÖŠµĆµ½ĮņĖį¼Ų¾§ĢåµÄ·½·ØŹĒÕō·¢½į¾§£»
£Ø6£©µē½āŹ±Ńō¼«·¢Éś·“Ӧɜ³ÉFeO42-£¬ŅĄ¾Ż»ÆŗĻ¼ŪµÄ±ä»ÆŗĶµēŗÉŹŲŗćŹéŠ“µē¼«·“Ó¦£®
½ā“š ½ā£ŗĄūÓĆĆ÷·ÆŹÆ£ØÖ÷ŅŖ³É·ÖŹĒK2SO4•Al2£ØSO4£©3•2Al2O3•6H2O£¬“ĖĶā»¹ŗ¬ÓŠÉŁĮæFe2O3ŌÓÖŹ£©ÖʱøAl2O3”¢K2FeO4ŗĶH2SO4µÄ¹¤ŅÕĮ÷³Ģ£ŗĆ÷·ÆĶŃĖ®ŗóÖ÷ŅŖ³É·ÖŹĒK2SO4•Al2£ØSO4£©3•2Al2O3£¬”°±ŗÉÕ”±Al2£ØSO4£©3ÖŠ+6¼Ū½µµĶĪŖSO2ÖŠ+4¼Ū£¬Al2£ØSO4£©3ŹĒŃõ»Æ¼Į£¬Įņµ„ÖŹĪŖ»¹Ō¼Į£¬·¢Éś2Al2£ØSO4£©3+3S$\frac{\underline{\;øßĪĀ\;}}{\;}$Al2O3+9SO2£¬ŹģĮĻČܽāĪŖŃõ»ÆĀĮÓėĒāŃõ»Æ¼ŲČÜŅŗ·“Ӧɜ³ÉĘ«ĀĮĖį¼Ų£¬Ąė×Ó·½³ĢŹ½ĪŖAl2O3+2OH-=2AlO2-+H2O£¬ŹģĮĻČܽāĖłµĆµÄČÜŅŗÖŠŗ¬ÓŠK+”¢SO42-”¢AlO2-”¢OH-µČ£¬¼ÓĮņĖįµ÷PHÖµ£¬AlO2-×Ŗ»ÆĪŖAl£ØOH£©3£¬×ĘÉÕÉś³ÉAl2O3£¬ÄøŅŗÖŠĄė×ÓÖ÷ŅŖÓŠK+”¢SO42-£¬ŗ¬ÓŠČÜÖŹĪŖK2SO4£¬ĀĖŌüĪŖFe2O3£¬¼ÓĮņĖįFe2O3+3H2SO4=Fe2£ØSO4£©3+3H2O£¬XĪŖFe2£ØSO4£©3£¬¼ÓĒāŃõ»Æ¼ŲFe2£ØSO4£©3+6KOH=2Fe£ØOH£©3”ż+3K2SO4£¬ĶØČėĀČĘų£ŗ2Fe£ØOH£©3+3Cl2+10KOHØT2K2FeO4+6KCl+8H2O£¬ÖʵĆK2FeO4£¬
£Ø1£©102gAl2O3µÄĪļÖŹµÄĮæŹĒ1mol£¬¼“Éś³É1molAl2O3Ź±Ņ²Éś³É3molµÄ¶žŃõ»ÆĮņ£¬ĮņĖįøłĄė×ÓÖŠSŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ+6¼Ū£¬¶žŃõ»ÆĮņÖŠµÄSŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ+4¼Ū£¬ĖłŅŌÉś³É3molµÄ¶žŃõ»ÆĮņ×ŖŅʵē×ÓµÄĪļÖŹµÄĮæŹĒ6mol£¬¼“3.612”Į1024»ņ6NA£¬¹Ź“š°øĪŖ£ŗ3.612”Į1024»ņ6NA£»
£Ø2£©³ĮµķIŹĒĒāŃõ»ÆĀĮ³Įµķ£¬Ć÷·ÆŹÆ¾¹żĶŃĖ®”¢±ŗÉÕ”¢ÓėĒāŃõ»Æ¼ŲČÜŅŗ·“Ó¦ŗóµĆµ½µÄČÜŅŗÖŠŗ¬ÓŠĘ«ĀĮĖįøłĄė×Ó£¬¼ÓČėĮņĖįÉś³ÉĒāŃõ»ÆĀĮ³Įµķ£¬Ąė×Ó·½³ĢŹ½ĪŖAlO2-+H++H2O=Al£ØOH£©3”ż£¬³ĮµķIIÓėĀČĘų”¢ĒāŃõ»Æ¼ŲČÜŅŗ·“Ӧɜ³ÉøßĢśĖį¼Ų£¬ĖłŅŌ³ĮµķIIµÄ»ÆѧŹ½ĪŖ Fe£ØOH£©3£¬
¹Ź“š°øĪŖ£ŗAlO2-+H++H2O=Al£ØOH£©3”ż£»Fe£ØOH£©3£»
£Ø3£©ĒāŃõ»ÆĀĮŹĒĘ«ĀĮĖį¼ŲČÜŅŗÓėĮņĖįČÜŅŗ·“Ó¦µÄ²śĪļ£¬ĖłŅŌĒāŃõ»ÆĀĮ³ĮµķÖŠæÉÄÜŗ¬ÓŠĮņĖįøłĄė×Ó£¬Ö¤Ć÷³ĮµķŹĒ·ńĻ“µÓøɾ»¼“Ö¤Ć÷Ļ“µÓŅŗÖŠŹĒ·ńŗ¬ÓŠĮņĖįøłĄė×Ó£¬Ö¤Ć÷·½·ØŹĒČ”×īŗóŅ»“ĪĻ“µÓŅŗÉŁŠķÓŚŹŌ¹ÜÖŠ£¬µĪ¼ÓBaCl2ČÜŅŗ£¬ČōĪŽÉ«°×É«³ĮµķÉś³É£¬ŌņŅŃĻ“øɾ»£¬
¹Ź“š°øĪŖ£ŗČ”×īŗóŅ»“ĪĻ“µÓŅŗÉŁŠķÓŚŹŌ¹ÜÖŠ£¬µĪ¼ÓBaCl2ČÜŅŗ£¬ČōĪŽÉ«°×É«³ĮµķÉś³É£¬ŌņŅŃĻ“øɾ»£»
£Ø4£©³ĮµķIIÓėĀČĘų”¢ĒāŃõ»Æ¼ŲČÜŅŗ·“Ӧɜ³ÉøßĢśĖį¼Ų£¬ĢśŌŖĖŲ»ÆŗĻ¼ŪÉżøߣ¬ĀČŌŖĖŲµÄ»ÆŗĻ¼Ū½µµĶ³ÉĪŖĀČĄė×Ó£¬»Æѧ·½³ĢŹ½ĪŖ2Fe£ØOH£©3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O£¬
¹Ź“š°øĪŖ£ŗ2Fe£ØOH£©3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O£»
£Ø5£©“ÓĮņĖį¼ŲČÜŅŗÖŠµĆµ½ĮņĖį¼Ų¾§ĢåµÄ·½·ØŹĒÕō·¢½į¾§£¬¹Ź“š°øĪŖ£ŗÕō·¢½į¾§£»
£Ø6£©ŅŌĢśĪŖµē¼«£¬µē½āÅصÄKOHČÜŅŗĄ“ÖĘČ”K2FeO4£¬Ńō¼«·¢ÉśŃõ»Æ·“Ó¦£¬K2FeO4ÖŠĢśŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ+6¼Ū£¬ĖłŅŌĢśŹ§6øöµē×ÓÓėĒāŃõøłĄė×Ó½įŗĻÉś³ÉFeO42-£¬µē¼«·“Ó¦Ź½ĪŖFe+8OH--6e-=FeO42-+4H2O£¬
¹Ź“š°øĪŖ£ŗFe+8OH--6e-=FeO42-+4H2O£®
µćĘĄ ±¾ĢāŅŌĀĮ”¢ĢśµÄ»ÆŗĻĪļĪŖŌŲĢåæ¼²éĮĖĪļÖŹ¼äµÄ·“Ó¦”¢ĪļÖŹµÄ·ÖĄėŗĶµē½āµČÖŖŹ¶µć£¬Ć÷Č·ĪļÖŹÖ®¼äµÄ·“Ó¦ŹĒ½ā±¾Ģā¹Ų¼ü£¬ÕāÖÖ×ŪŗĻŠŌ½ĻĒæµÄĢāŠĶŹĒøßæ¼ČČµć£¬ŠėĄūÓĆ»ł“”ÖŖŹ¶ĻøŠÄ·ÖĪö½ā“š£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā


 £¬GÖŠ¹ŁÄÜĶŵÄĆū³ĘĪŖĢ¼Ģ¼Ė«¼ü”¢õ„»ł£®
£¬GÖŠ¹ŁÄÜĶŵÄĆū³ĘĪŖĢ¼Ģ¼Ė«¼ü”¢õ„»ł£® £¬·“Ó¦ĄąŠĶ¼Ó³É·“Ó¦£®
£¬·“Ó¦ĄąŠĶ¼Ó³É·“Ó¦£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ü¢Ż¢Ž | B£® | ¢Ś¢Ū | C£® | ¢Ū¢Ü¢Ž | D£® | ¢Ś¢Ū¢Ž |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
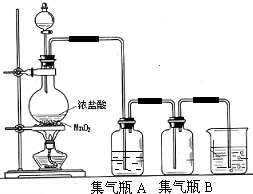
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
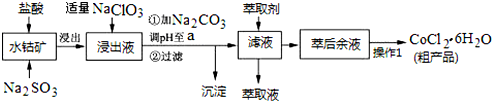
| ³ĮµķĪļ | Fe£ØOH£©3 | Fe£ØOH£©2 | Co£ØOH£©2 | Al£ØOH£©3 | Mn£ØOH£©2 |
| æŖŹ¼³Įµķ | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| ĶźČ«³Įµķ | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
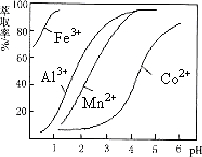
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
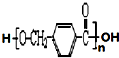
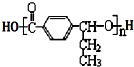
 £¬ĘäÖŠµÄ¹ŁÄÜĶÅĆū³ĘĪŖĀČŌ×Ó£®
£¬ĘäÖŠµÄ¹ŁÄÜĶÅĆū³ĘĪŖĀČŌ×Ó£®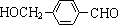 +2Ag£ØNH3£©2OH $\stackrel{”÷}{”ś}$
+2Ag£ØNH3£©2OH $\stackrel{”÷}{”ś}$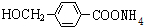 +2Ag”ż+3NH3+H2O£¬ÓÉDÉś³Éøß·Ö×Ó»ÆŗĻĪļµÄ·“Ó¦n
+2Ag”ż+3NH3+H2O£¬ÓÉDÉś³Éøß·Ö×Ó»ÆŗĻĪļµÄ·“Ó¦n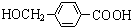 $\stackrel{Ņ»¶ØĢõ¼ž}{”ś}$
$\stackrel{Ņ»¶ØĢõ¼ž}{”ś}$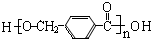 +£Øn-1£©H2O
+£Øn-1£©H2O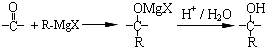
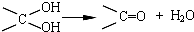
 ŌŚŗĻ³É¹ż³ĢÖŠĖłÓƵÄøńŹĻŹŌ¼ĮµÄ»ÆѧŹ½ĪŖCH3CH2MgX£ØÓĆX±ķŹ¾Ā±Ō×Ó£©£¬ŗĻ³É¹ż³ĢÖŠÉę¼°µ½µÄÓŠ»ś»Æѧ·“Ó¦ĄąŠĶÓŠACD£ØĢī±ąŗÅ£©
ŌŚŗĻ³É¹ż³ĢÖŠĖłÓƵÄøńŹĻŹŌ¼ĮµÄ»ÆѧŹ½ĪŖCH3CH2MgX£ØÓĆX±ķŹ¾Ā±Ō×Ó£©£¬ŗĻ³É¹ż³ĢÖŠÉę¼°µ½µÄÓŠ»ś»Æѧ·“Ó¦ĄąŠĶÓŠACD£ØĢī±ąŗÅ£©²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
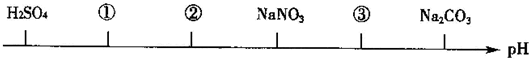
| A£® | CuCl2 CH3COOH NaOH | B£® | HCl H2SO3 NaHCO3 | ||
| C£® | HF HCl CH3COONa | D£® | NH4Cl HCl CH3COONa |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Čō2H2£Øg£©+O2£Øg£©ØT2H2O£Øg£©”÷H=-483.6 kJ•mol-1£¬ŌņH2Č¼ÉÕČČĪŖ241.8 kJ•mol-1 | |
| B£® | ŌŚĻ”ČÜŅŗÖŠ£ŗH+£Øaq£©+OH-£Øaq£©ØTH2O£Øl£©”÷H=-57.3 kJ/mol£¬Čō½«ŗ¬0.6 mol H2SO4µÄĻ”ĮņĖįÓėŗ¬1 mol NaOHµÄČÜŅŗ»ģŗĻ£¬·Å³öµÄČČĮæ“óÓŚ57.3 kJ | |
| C£® | ŅŃÖŖC£ØŹÆÄ«£¬s£©ØTC£Ø½šøÕŹÆ£¬s£©”÷H£¾0£¬Ōņ½šøÕŹÆ±ČŹÆÄ«ĪČ¶Ø | |
| D£® | ÓÉBaSO4£Øs£©+4C£Øs£©ØT4CO£Øg£©+BaS£Øs£©”÷H1=+571.2kJ•mol-1¢ŁBaSO4£Øs£©+2C£Øs£©ØT2CO2£Øg£©+BaS£Øs£©”÷H2=+226.2kJ•mol-1¢ŚæɵƷ“Ó¦C£Øs£©+CO2£Øg£©ØT2CO£Øg£© µÄ”÷H=+172.5kJ•mol-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com