
| A.(I)用① | B.(Ⅱ)用② | C.(Ⅲ)用③ | D.(Ⅳ)用④ |
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源:不详 题型:单选题
| A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中每生成2 mol AlN,N2得到3 mol电子 |
| C.氮化铝中氮元素的化合价为-3价 |
| D.氮化铝属于复合材料 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
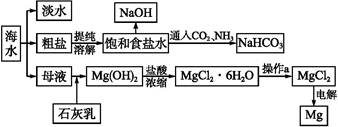
| | MgO | MgCl2 |
| 熔点/℃ | 2 852 | 714 |
| 沸点/℃ | 3 600 | 1 412 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
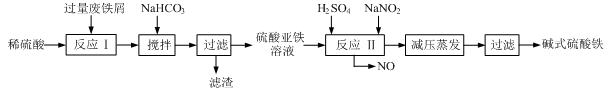
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
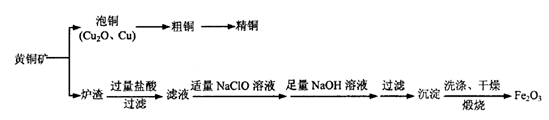
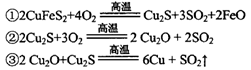
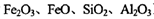 )可制备Fe2O3。根据流程回答下列问题:
)可制备Fe2O3。根据流程回答下列问题:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
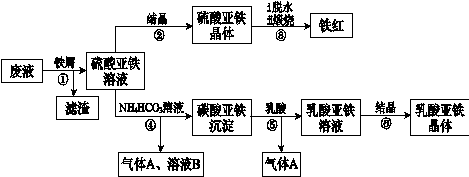
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
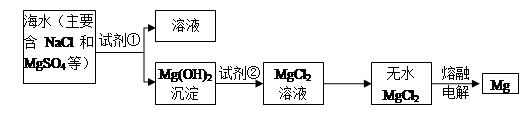
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com