
| A、常温下,1L 0.1mol/L的NH4NO3溶液中氮原子数为0.2NA |
| B、常温常压下,22.4L CH4含有4NA个C-H共价键 |
| C、2mol N2与2mol H2混合充分反应,转移的电子数目为4NA |
| D、10L pH=1的硫酸溶液中含有的H+离子数为2NA |


科目:高中化学 来源: 题型:
| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
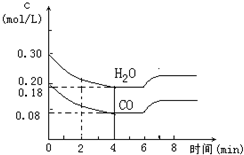
查看答案和解析>>
科目:高中化学 来源: 题型:
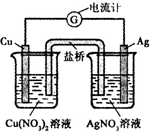 完成下列各题:
完成下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:
A、石灰乳与Na2CO3溶液混合:Ca 2++C
| ||||
B、向沸水中滴加FeCl3溶液并加热制备Fe(OH)3胶体:Fe3++3H2O
| ||||
C、向CH2BrCOOH中加足量的氢氧化钠溶液并加热:CH 2BrCOOH+2OH-
| ||||
| D、FeO与稀硝酸反应:FeO+6H++NO3-=Fe3++NO↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能说明NH3结合H+能力比H2O强:NH3+H2O?NH4++OH- |
| B、能说明氧化性H2O2>Fe3+:2Fe2++H2O2+2H+=2Fe3++2H2O |
| C、能说明盐酸的酸性比碳酸强:2HCl+CaCO3=CaCl2+H2O+CO2↑ |
| D、能说明CH3COOH是弱酸:CH3COO-+H2O?CH3COOH+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,分子数为NA的C0、C2H4.混合气体体积约为22.4L,质量为28g |
| B、25℃时,pH=2的1.OL H2SO4溶液中含有的H+数目为0.2NA |
| C、4.6g Na在空气中完全反应生成Na2O Na2O2混合物,转移电子数目为0.2NA |
| D、1mol金刚石和晶体桂的混合物中,含有共价键数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol NaHSO4晶体中含有的离子总数为3NA |
| B、常温下,0.1mol/L Na2C03溶液中C032-的数目一定小于0.1NA |
| C、标准状况下,2.24LCH3Cl中含有的共用电子对数为O.4NA |
| D、用石墨作电极电解CuSO4溶液,当阳极产生2.24L标准状况下的气体时,流经溶液的电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将醋酸溶液加水稀释1000倍,pH增大3 |
| B、在NaHCO3溶液中,c(Na+)=c(HCO3-)+c(H2CO3) |
| C、pH=8的Ba(OH)2溶液和pH=8的氨水中,由水电离的c(OH-)均为1×10-8mo1?L-1 |
| D、pH=13的NaOH溶液与pH=1的盐酸混合后,一定有c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com