

���� ��1�������Ȼ�ѧ����ʽ��˹���ɼ���õ������Ȼ�ѧ����ʽ�����ݸ�˹���ɣ���-�١�2����2�õ���
��2�����ɹ�������ͼ��֪��SO2��I2��H2O��Ӧ����H2SO4��HIX����ƽ��д����ʽ��
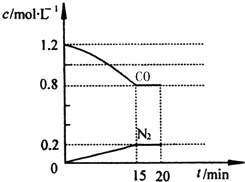
����ͼ1��֪��ƽ��ʱ���������ʵ���Ϊ0.1mol���ݴ���������ʽ����ƽ��ʱ����ֵ����ʵ��������ڷ�Ӧǰ����������ʵ������䣬�ʿ����������ʵ�������Ũ�ȴ���ƽ�ⳣ������ʽ���㣬�÷�Ӧ����Ӧ�����ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ�ƶ���ƽ�ⳣ������
����ͼ2��֪����������Ix-ת��ΪI-����������Ix-ת��ΪI2����������H+ͨ������Ĥ��������������������HI��Һ�������HIx����I2��HI��
�ݷ�����Ӧ�����в��뷴Ӧ������ɵ����ʿ���ѭ�����ã�
��� �⣺��1����SO2��g��+2CO��g���T2C02��g��+$\frac{1}{x}$Sx��s����H=a kJ•mol-1��
��2COS��g��+SO2��g���T2CO2��g��+$\frac{3}{x}$Sx��s����H=b kJ•mol-1��
���ݸ�˹���ɣ���-�١�2����2�õ���xCOS��g��=xCO��g��+Sx��s����H=0.5x��b-a��kJ/mol��
�ʴ�Ϊ��xCOS��g��=xCO��g��+Sx��s����H=0.5x��b-a��kJ/mol��
��2�����ɹ�������ͼ��֪��SO2��I2��H2O��Ӧ����H2SO4��HIX����Ӧ����ʽΪ��SO2+x I2+2H2O�TH2SO4+2HIX��
�ʴ�Ϊ��SO2+x I2+2H2O�TH2SO4+2HIX��
����ͼ1��֪��ƽ��ʱ���������ʵ���Ϊ0.1mol����
2HI��g��?H2��g��+I2��g��
��ʼ��mol����1 0 0
�仯��mol����0.2 0.1 0.1
ƽ�⣨mol����0.8 0.1 0.1
���ڷ�Ӧǰ����������ʵ������䣬�ʿ����������ʵ�������Ũ�ȼ���ƽ�ⳣ������K=$\frac{0.1��0.1}{0��{8}^{2}}$=$\frac{1}{64}$��
�÷�Ӧ����Ӧ�����ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ�ƶ���ƽ�ⳣ������
�ʴ�Ϊ��$\frac{1}{64}$������
����ͼ2��֪����������Ix-ת��ΪI-����������Ix-ת��ΪI2�����������������ķ�ӦΪ��2Ix--2e-=xI2��H+ͨ������Ĥ��������������������HI��Һ�������HIx����I2��HI����Ӧ����ʽΪ��2HIx�T��x-1��I2+2HI��
�ʴ�Ϊ��2Ix--2e-=xI2��2HIx=��x-1��I2+2HI��
���ɹ�������ͼ��֪��SO2��I2��H2O��Ӧ����H2SO4��HIX���ڵ�����װ�ú�Ĥ��Ӧ�������ɵⵥ�ʣ�������������������ѭ�����õ������ǵⵥ�ʣ��ʴ�Ϊ��I2��
���� ���⿼���˹���ɼ��㡢����Ũ�ȴ�С�Ƚϡ����ԭ���ȣ�������ѧ���ķ��������Ŀ��飬Ϊ�߿��������ͣ���Ŀ�Ѷ��еȣ�ע�������غ�˼��Ƚ���Һ����Ũ�ȴ�С��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | d��Ԫ��ȫ���ǽ���Ԫ�� | B�� | ��IAԪ�ش��ϵ����۷е����ν��� | ||
| C�� | ������Ԫ�ش�����I1�������� | D�� | �縺������Ԫ����He |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
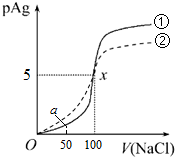
| A�� | ԭAgNO3��Һ�����ʵ���Ũ��Ϊ1mol•L-1 | |
| B�� | K����AgCl��=1��10-10 | |
| C�� | a��ʱ����Һ��c��Cl-��=1.2��10-9mol•L-1 | |
| D�� | ����0.1mol•L-1��NaCl��Һ����0.1mol•L-1��NaI��Һ����pAg�ı仯ͼ�������ߢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �״�������ȡ��ȩ��ԭ��ΪCH3OH��g��?HCHO��g��+H2��g����ij����С����1L�����ܱ������г���1molCH3OH���Ը÷�Ӧ������һϵ�е��о����õ��״���ƽ��ת�������¶ȵı仯������ͼ��ʾ��
�״�������ȡ��ȩ��ԭ��ΪCH3OH��g��?HCHO��g��+H2��g����ij����С����1L�����ܱ������г���1molCH3OH���Ը÷�Ӧ������һϵ�е��о����õ��״���ƽ��ת�������¶ȵı仯������ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C50��N70��C120��C540�Ȼ���Ϊͬ�������� | |
| B�� | CH3CH2CH2CH2OH�������ǣ����� | |
| C�� | 2-��ϩ�Ľṹ��ʽ��CH3CH2CH=CHCH3 | |
| D�� | ������Ϊ94��������Ϊ144���У�Pu��ԭ�ӣ�${\;}_{92}^{144}$Pu�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NA���������ӵ�������1molC4H10�к����ۼ���ĿΪ14NA | |
| B�� | ij��Ӧ�ġ�H=-88kJ•mol-1��������Ӧ���һ��С��88kJ•mol-1 | |
| C�� | ��֪ij�¶��£�Kw=l��10-13������pH=8��NaOH��Һ��pH=5��H2SO4��Һ��ϱ����¶Ȳ��䣬��ʹ�����ҺpH=7����NaOH��Һ��H2SO4��Һ�������Ϊ11��9 | |
| D�� | ��Ũ��Ϊ0.1 mol•L-1 HF��Һ��ˮ����ϡ�����У�����Ⱥ�Ka��HF�����ֲ��䣬$\frac{c��{F}^{-}��}{c��{H}^{+}��}$ʼ�ձ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʵ������п��ϡ���ᷴӦʱ���μ���������ͭ��Һ�ܼӿ췴Ӧ���ʣ���Ϊ����ͭ�Ǵ��� | |
| B�� | ij�¶��£�һ��������ܱ������н��п��淴Ӧ��X��g��+Y��g��=Z��g��+W��g����H��0��ƽ������һ����X�����H���� | |
| C�� | �¶Ⱥ�ѹǿһ��ʱ�����ڿ��淴Ӧ��2NO2��g��?N2O4��g�������������ܶȲ��ٸı䣬��Ӧ�ﵽƽ��״̬ | |
| D�� | ��NaAlO2��Һ��NaHCO3��Һ��Ϻ����ɰ�ɫ��������������Һˮ����ٽ��Ľ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com