
【题目】某温度下,反应ClF(g)+F2(g) ![]() ClF3(g) △H = -268 kJ·mol-1 在密闭容器中达到平衡。下列说法正确的是 ( )
ClF3(g) △H = -268 kJ·mol-1 在密闭容器中达到平衡。下列说法正确的是 ( )
A. 温度不变,缩小体积,ClF的转化率增大
B. 温度不变,增大体积,ClF3产率提高
C. 升高温度,增大体积,有利于平衡向正反应方向移动
D. 降低温度,体积不变,F2转化率降低
【答案】A
【解析】
本题所列反应是正反应为放热、体积缩小的可逆反应。可依据温度、压强、浓度的变化对平衡的影响以及气体的体积和压强、浓度的关系进行判断。
A、温度不变,缩小气体的体积,使平衡向气体体积增大的正反应方向移动,所以,ClF的转化率增大,选项A正确;B、温度不变,增大体积,其压强必然减小,使平衡向逆反应方向移动。所以,ClF3的产率应降低,不应增高,选项B错误;C、升高温度,对放热反应来说,可使平衡向逆反应方向移动。同时,增大体积即减小压强,亦使平衡向逆反应方向移动,选项C错误;D、降低温度,体积不变,有利于平衡向放热反应方向移动,使F2的转化率升高,选项D错误。答案选A。


科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A. 2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)在低温下能自发进行,则该反应的ΔH < 0
B. 反应NH4Cl(s)=NH3(g)+HCl(g)的ΔS < 0
C. 若ΔH > 0,ΔS < 0,化学反应在任何温度下都能自发进行
D. 加入合适的催化剂能降低反应活化能,从而改变反应的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有W、X、Y、Z四种短周期元素,W分别与X、Y、Z结合生成甲、乙、丙三种化合物,且每个甲、乙、丙分子中均含10个电子,Y和Z化合生成丁,有关物质的转化关系如下图所示。下列说法错误的是
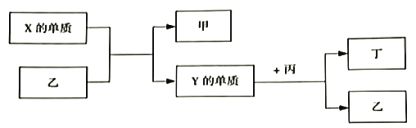
A. 原子序数由小到大的顺序是:W<Z<Y<X
B. Z的最高价氧化物对应的水化物一定为强酸
C. 化合物的沸点由高到低的顺序是:乙>甲>丙
D. Y与W、Z都能形成两种或两种以上的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg / LiFePO4电池的电池反应为xMg2++2LiFePO4![]() xMg+2Li1-xFePO4+2xLi+,其装置示意图如下:
xMg+2Li1-xFePO4+2xLi+,其装置示意图如下:

下列说法正确的是
A. 放电时,Li+被还原
B. 充电时,电能转变为化学能
C. 放电时,电路中每流过2mol电子,有1molMg2+迁移至正极区
D. 充电时,阳极上发生的电极反应为LiFePO4-xe-= Li1-xFePO4 + xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g) ![]() 2C3(g);△H=-akJ·mol-1(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol·L-1,放出热量b kJ。请回答下列问题:
2C3(g);△H=-akJ·mol-1(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol·L-1,放出热量b kJ。请回答下列问题:
(1)比较a___________b填“>”、“=”、“<”)。
(2)若将反应温度升高到700℃,该反应的平衡常数将_____________(“增大”、“减小”或“不变”)。
(3)能说明该反应已经达到平衡状态的是
A.V(C3)=2V(B2) B.容器内气体压强保持不变
C.V逆(A2)=2V正(B2) D.容器内的气体密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是_____________。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H(碘他拉酸)可用于CT检查、动静脉造影等,其一种合成路线如下:

(1)H中的含氧官能团名称为_____。
(2)F→G的反应类型为_____。
(3)E的分子式为C9H8N2O5,E→F发生还原反应,写出E的结构简式:_____。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_____。
①在酸性条件下能水解生成X、Y、Z三种有机物。
②X是一种氨基酸,Y能发生银镜反应,Z能与FeCl3溶液发生显色反应且分子中只有2种不同化学环境的氢。
(5)泛影酸丙酯( )是一种医学诊断剂,写出以
)是一种医学诊断剂,写出以 、CH3CH2CH2Cl和(CH3CO)2O为原料制备泛影酸丙酯的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) _________________。
、CH3CH2CH2Cl和(CH3CO)2O为原料制备泛影酸丙酯的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) _________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种非金属元素(除H外),A、B在反应中各结合1个电子,形成稳定结构,与氢气化合产物的稳定性,B>A;原子序数C>D,C、D的稳定结构的核外电子数与A的稳定结构的核外电子数相等,则四种元素的非金属性由强到弱的排列顺序正确的是( )
A.A、B、D、CB.B、A、D、CC.A、B、C、DD.B、A、C、D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅陶瓷能代替金属制造发动机的耐热部件。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g) △H<0。若在恒压绝热容器中反应,下列选项表明反应一定已达化学平衡状态的是( )
Si3N4(s)+12HCl(g) △H<0。若在恒压绝热容器中反应,下列选项表明反应一定已达化学平衡状态的是( )
A. 容器的温度保持不变 B. 容器的压强保持不变
C. υ正(N2)=6υ逆(HCl) D. 容器内的气体c(N2)∶c(H2)∶c(HCl)=1∶3∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)O2、SO2、SO3三者质量之比为1∶2∶5,则它们的氧原子数之比为______。
(2)11.7gNaX含有Na+0.2 mol,则NaX的摩尔质量为_____。
(3)相同浓度的NaCl、MgCl2、AlCl3溶液,分别与AgNO3溶液反应,当生成的AgCl沉淀的质量之比为3∶2∶1时,三种溶液的体积比为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com