
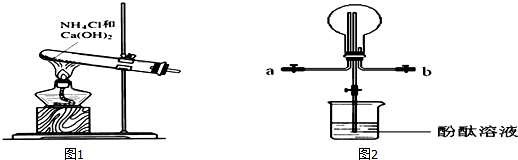
分析 (1)写出正极电极反应式,用总反应式减去正极反应式即为负极反应式;
(2)先出现红色,则在阴极上放出氢气,氢氧根浓度增大,则其极与电源负极相连,为阴极,电极反应式为:2H2O+2e-═H2↑+2OH-;
(3)强酸与强碱反应,可用酚酞作指示剂,滴定前,酚酞遇碱无色,滴定后若变红色,停止滴定;根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,判断不当操作对V(标准)影响,从而判断对浓度的影响;
(4)pH相等的NaOH和氨水溶液,氨水浓度大于NaOH溶液,加水稀释促进一水合氨电离,NaOH在溶液中完全电离,据此分析.
解答 解:(1)甲烷燃料电池中,甲烷在负极失电子,氧气在正极得电子,电极反应式为:O2+4e-+2H2O═4OH-,用总反应式减去正极反应式得负极反应式:CH4-8e-+10OH-=CO32-+7H2O,故答案为:负;CH4-8e-+10OH-=CO32-+7H2O;
(2)先出现红色,则在阴极上放出氢气,氢氧根浓度增大,则其极与电源负极相连,为阴极,电极反应式为:2H2O+2e-═H2↑+2OH-,故答案为:阴;2H2O+2e-═H2↑+2OH-;
(3)强酸与强碱反应,可用酚酞作指示剂,滴定前,酚酞遇碱无色,滴定溶液由无色变为粉红色,且30s内不褪色;
A.锥形瓶用蒸馏水洗后用待测液润洗,无影响,故不选;
B.在洁净干燥的碱式滴定管未用标准液润洗即装标准液,标准液浓度变小,V(标准)偏大,所以测得HCl溶液浓度偏高,故不选;
C.滴定过程中,锥形瓶内液体溅出瓶外,消耗V(标准)偏小,所以测得HCl溶液浓度偏低,故选;
D.配制NaOH标准溶液定容时仰视容量瓶标线,标准液浓度偏低,浓度变小,所以V(标准)偏大,所以测得HCl溶液浓度偏高,故不选;
故选C;故答案为:酚酞;溶液由无色变为粉红色,且30s内不褪色;C;
(4)加水稀释促进一水合氨电离,将等体积、等pH的氢氧化钠溶液和氨水分别稀释相同倍数,氨水中氢氧根离子浓度大于NaOH,氨水pH大于NaOH溶液,若使稀释后pH相等,氨水稀释倍数应大于氢氧化钠,即m<n,故答案为:<.
点评 本题考查了电化学电极反应式的书写、中和滴定操作、误差分析、弱电解质存在电离平衡,加水稀释促进弱电解质的电离,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| X | |||
| Y | Z | R | W |
| A. | 该五种元素一定为非金属元素 | |
| B. | 元素Y、Z、R的氧化物一定属于三种不同类型的晶体 | |
| C. | Z的原子序数可能是X的两倍 | |
| D. | W的最高价氧化物对应的水化物可能是最强的无机含氧酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
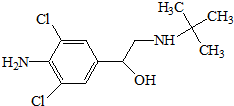 瘦肉精,学名盐酸克伦特罗,该药物既不是兽药,也不是饲料添加剂,而是肾上腺类神经兴奋剂,可以增加动物的瘦肉量.减少饲料使用.使肉品提早上市,降低成本,但对人体会产生副作用,盐酸克伦特罗分子结构简式如图.下列说法不正确的是( )
瘦肉精,学名盐酸克伦特罗,该药物既不是兽药,也不是饲料添加剂,而是肾上腺类神经兴奋剂,可以增加动物的瘦肉量.减少饲料使用.使肉品提早上市,降低成本,但对人体会产生副作用,盐酸克伦特罗分子结构简式如图.下列说法不正确的是( )| A. | 瘦肉精的分子式是C11H18ON2Cl2 | |
| B. | 物质能发生取代反应、氧化反应、加成反应和水解反应 | |
| C. | 1mol盐酸克伦特罗最多能与4molNaOH反应 | |
| D. | 盐酸克伦特罗分子中至少有7个碳原子共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性按X、Y、Z的顺序递增 | |
| B. | 三种元素的最高价氧化物对应的水化物酸性:H2ZO3>H3YO4>H2XO4 | |
| C. | 元素的最高正化合价按X、Y、Z的顺序递减 | |
| D. | 元素原子的半径按X、Y、Z的顺序递减 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
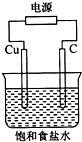
| A. | 石墨电极与直流电源负极相连 | |
| B. | 铜电极的反应式为:2H++2e-═H2↑ | |
| C. | 氢氧化钠在石墨电极附近产生,Na+向石墨电极迁移 | |
| D. | 用湿润KI淀粉试剂在铜电极附近检验气体,试纸变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
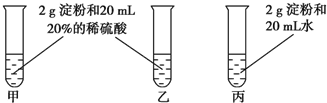 为检验淀粉水解的情况,进行如图所示的实验,试管甲和丙均用60~80℃的水浴加热5~6min,试管乙不加热.待试管甲中的溶液冷却后再进行后续实验.
为检验淀粉水解的情况,进行如图所示的实验,试管甲和丙均用60~80℃的水浴加热5~6min,试管乙不加热.待试管甲中的溶液冷却后再进行后续实验.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的物质,其物质的量必然相等 | |
| B. | 任何条件下,等物质的量的乙烯(C2H4)和一氧化碳所含的分子数必然相等 | |
| C. | 10g一氧化碳气体和10g氧气的体积相等 | |
| D. | 同温同压下,等体积的物质所含的分子数一定相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com