
分析 同一主族元素从上到下元素的非金属性逐渐减弱,金属性逐渐增强,非金属性越强,则对应的最高价氧化物的水合物的酸性越强;
同一周期元素从左到右元素的金属性逐渐减弱,金属性越弱,则对应的最高价氧化物的水合物的碱性越弱;同一主族元素从上到下元素的金属性逐渐增强,金属性越强,则对应的最高价氧化物的水合物的碱性越强.
解答 解:(1)N和P在同一主族,P在N元素的下一周期,同一主族元素从上到下元素的非金属性逐渐减弱,则非金属性N>P,非金属性越强,则对应的最高价氧化物的水合物的酸性越强,所以:酸性H3PO4<HNO3,故答案为:<;
(2)Ca位于第四周期第IIA族,Mg位于第三周期第ⅡA族,同一主族元素从上到下元素的金属性逐渐增强,则金属性Ca>Mg,所以碱性Ca(OH)2>Mg(OH)2,故答案为:>;
(3)Mg位于第三周期第IIA族,Al位于第三周期IIIA族,同一周期元素从左到右元素的金属性逐渐减弱,金属性越弱,则对应的最高价氧化物的水合物的碱性越弱,则金属性Mg>Al,所以碱性Al(OH)3<Mg(OH)2,故答案为:<;
(4)S和P在同一周期,则非金属性S>P,非金属性越强,则对应的最高价氧化物的水合物的酸性越强,所以:酸性H3PO4<H2SO4,故答案为:<.
点评 本题考查金属性和非金属性的递变规律,注意元素周期律的递变规律,以及对应最高价氧化物对应水化物的酸性和碱性的比较,题目比较基础.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
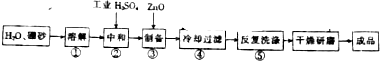
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
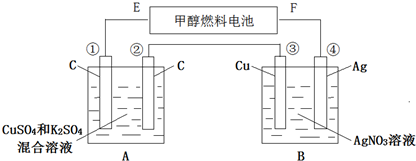
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁均有水珠 | 两种物质均受热分解 |
| B | 向某溶液中滴加氯水后再加入KSCN溶液 | 溶液呈红色 | 溶液中一定含有Fe2+ |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结. | NH4Cl固体可以升华 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极的电极反应式为:O2+4H++4e-═2H2O | |
| B. | 溶液中阴离子向正极移动 | |
| C. | 负极的电极反应式为:N2H4+4OH--4e-═4H2O+N2 | |
| D. | 电解质溶液的pH保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水中滴加石蕊试液显蓝色 | |
| B. | NO2通入水中,气体由红棕色逐渐转变为无色 | |
| C. | 萃取时向碘水中滴加适量的稀盐酸,有透明的凝胶形成 | |
| D. | 向硅酸钠溶液中滴加适量的稀盐酸,有透明的凝胶形成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com