
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,3.2 g 14C18O中含中子数为1.4NA
B. CO燃烧热为283.0 kJ/mol,若一定量的CO完全燃烧放出热量为283.0 kJ,则消耗O2分子数为NA
C. 等体积、等物质的量浓度的NaCl和KF溶液中,阴、阳离子数目之和相等
D. 室温下,21.0 gC2H4和C4H8的混合气体中含有的原子数目为4.5 NA
【答案】D
【解析】
A.3.2 g 14C18O中含中子数为![]() =1.8NA,故A错误;
=1.8NA,故A错误;
B.CO燃烧热为283.0 kJ/mol,若CO完全燃烧放出热量为283.0 kJ,说明是1molCO完全燃烧,则消耗O2分子数为![]() NA,故B错误;
NA,故B错误;
C.利用电荷守恒来理解:NaCl溶液中存在C(Na+)+ C(H+) = C(OH-)+ C(Cl-),NaF溶液中存在C(Na+)+ C(H+)= C(OH-)+ C(F-) ,由于NaF水解,使得NaF溶液显碱性,NaF溶液中C(H+)<NaCl溶液中的C(H+),而两溶液中[Na+]浓度相等,所以NaF溶液中的C(Na+)+ C(H+)小于NaCl溶液中的C(Na+)+ C(H+),又因为电荷守恒,所以NaF溶液中C(OH-)+ C(F-)小于NaCl溶液中C(OH-)+ C(Cl-),故C错误;
D. C2H4和C4H8的最简式相同,可以先计算最简式CH2的物质的量,再计算原子数目,所以21.0 gC2H4和C4H8的混合气体中含有的原子数目为![]() 4.5 NA;故D正确;
4.5 NA;故D正确;
正确答案:D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
①工业合成氨N2(g)+3H2(g)![]() 2NH3(g) △H<0,反应条件选择高温
2NH3(g) △H<0,反应条件选择高温
②实验室可以用排饱和食盐水的方法收集氯气
③硫酸工业中2SO2+O2![]() 2SO3,增大O2的浓度有利于提高SO2的转化率
2SO3,增大O2的浓度有利于提高SO2的转化率
④对CO(g)+NO2(g)![]() CO2(g) + NO(g)平衡体系增大压强可使颜色变深
CO2(g) + NO(g)平衡体系增大压强可使颜色变深
A. ②③ B. ②④ C. ①③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容容器中,当下列物理量不再发生变化时,能说明下列反应:C(s)+CO2(g) ![]() 2CO(g)达到平衡状态的是:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的浓度之比等于化学计量数之比,⑦某种气体的百分含量
2CO(g)达到平衡状态的是:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的浓度之比等于化学计量数之比,⑦某种气体的百分含量
A. ①③④⑤⑦ B. ①②③④⑦
C. ②③④⑥⑦ D. ①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物E是医药合成中间体。其合成路线如下:

(1)![]() 的官能团名称为_____________。E的分子式为_______________。
的官能团名称为_____________。E的分子式为_______________。
(2)B→D的过程中,B分子的羧基全部酯化,写出该反应方程式:_________________。
(3)D→E的反应历程如下:

写出反应Ⅱ、Ⅲ的反应类型:Ⅱ_____________、Ⅲ_____________
(4)写出满足下列条件的A的所有同分异构体的结构简式___________________。
a.能与新制氢氧化铜悬浊液反应产生砖红色沉淀
b.常温下能与Na2CO3反应并释放出气体
(5)请写出以CH2=CH2为主要原料(无机试剂任用)制备OHC—CHO(乙二醛)的合成路线流程图(须注明反应条件)_______。(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化成绿色;见光则分解,变成褐色。如图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:

根据以上信息回答下列问题:
(1)生产过程中X的化学式为________。
(2)写出产生CuCl的化学方程式:__________________________________________。
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由_____________________________________________________
实际生产中SO2要适当过量,原因可能是_______________________________(答一点即可)。
(4)实验探究pH对CuCl产率的影响如下表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl产率/% | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出CuCl晶体最佳pH为________,当pH较大时CuCl产率变低,原因是________________________________________________________________________。调节pH时,________(填“能”或“不能”)用相同pH的硝酸代替硫酸,理由__________________。
(5)氯化亚铜的定量
①称取样品0.25 g和过量的FeCl3溶液于锥形瓶中,充分溶解。
②用0.10 mol·L-1硫酸铈标准溶液滴定。已知:CuCl+FeCl3===CuCl2+FeCl2、Fe2++Ce4+===Fe3++Ce3+。三次平行实验结果如下(平行实验结果相差不能超过1%):
平行实验次数 | 1 | 2 | 3 |
0.25 g样品消耗硫酸铈 标准溶液的体积/mL | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为________(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象与所对应的实验相符的是( )
A. 向硫酸溶液中不断加水 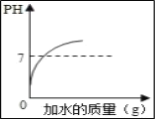
B. 一定量的稀硫酸与锌粒反应 
C. 加热二氧化锰和氯酸钾的混合物 
D. 向稀H2SO4中滴加BaCl2溶液 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某活动小组利用如图实验装置制取氧气并进行探究活动。

(1)写出标号仪器的名称:①_____,②____。
(2)用装置A制取氧气的化学方程式是____。若用装置A、B、C来制取一瓶干燥的氧气,装置B中应盛放的是___,导管口的连接顺序是_____。
(3)集气瓶内收集到的气体中氧气的体积分数是多少呢?
[实验验证]活动小组设计了以下两套实验装置,用来测定该瓶气体中氧气的体积分数。在氮气环境下,将过量的铜粉分别装入干燥的硬质玻璃管和具支试管后,密封。用两支干燥的注射器从该瓶中抽取气体,分别按图M1-6连接,推拉注射器一段时间后,用酒精灯在铜粉部位加热,加热时反复推拉注射器至反应完全。

①甲装置比乙装置更合理,理由是_______。
②用甲装置测定氧气的体积分数,需要测定的实验数据是_____。
[反思交流]实验完毕,待装置冷却至室温后,应先将气球内的气体全部挤出,再读数,否则会使测得的实验结果______ (填“偏大”偏小”或“无影响”),原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界能源消费的90%以上依靠化学技术。回答下列问题:
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气。
已知:C(s)+![]() O2(g)=CO(g) △H1=-110.35kJ·mol-1
O2(g)=CO(g) △H1=-110.35kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
H2O(1)=H2O(g) △H3=+44.0kJ·mol-1
则反应C(s)+H2O(g)![]() CO(g)+H2(g) △H4=___________。
CO(g)+H2(g) △H4=___________。
某实验小组在实验室模拟反应C(s)+H2O(g)![]() CO(g)+H2(g),其平衡常数表达式为K=___________。一定温度下,在2L盛有足量炭粉的恒容密闭容器中通入0.8molH2O,6min时生成0.7gH2。则6min内以CO表示的平均反应速率为___________(保留3位有效数字)。
CO(g)+H2(g),其平衡常数表达式为K=___________。一定温度下,在2L盛有足量炭粉的恒容密闭容器中通入0.8molH2O,6min时生成0.7gH2。则6min内以CO表示的平均反应速率为___________(保留3位有效数字)。
(2)燃料气(主要含N2和H2,还含有少量其他杂质)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除。CeO2可由草酸铈[Ce(C2O4)3]灼烧制得,反应的化学方程式为___________。在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度的变化如下图所示。
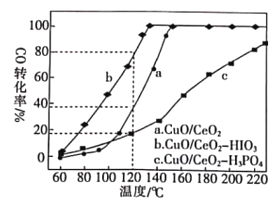
加入H3PO4___________(填“促进”或“抑制”)CuO/CeO2的催化。温度为120℃,催化剂为CuO/CeO2-HIO3时,若燃料气流速为1800mL·min-1,CO的体积分数为0.68%,则反应0.5h后CO的体积为___mL。
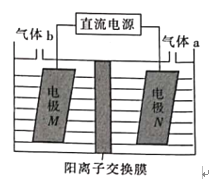
(3)LiOH是制备锂离子电池正极材料的重要原料,利用LiCl溶液电解制备得LiOH的装置如下图,LiOH在___________(填“M极”或“N极”)制得,N极产生的气体a通入淀粉KI溶液溶液变蓝,持续一段时间后,蓝色可逐渐褪去。据此写出N极的电极反应式:__________,蓝色逐渐褪去是因为溶液中逐渐生成HIO3,写出此反应的化学方程式:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com