
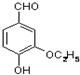
 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.
 .
. .
. )是一种医药中间体,请设计合理方案用对甲基苯酚合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
)是一种医药中间体,请设计合理方案用对甲基苯酚合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).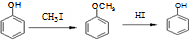
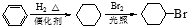
 .
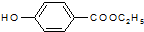
.分析 (1)乙基香草醛的同分异构体A是一种有机酸,则A中含有羧基,A被氧化后生成的B能发生银镜反应,则说明B含有醛基,A含有-CH2OH,由A与C的分子式可知,A中-OH被-Br取代生成C,A能被酸性高锰酸钾溶液氧化生成苯甲酸,则A是 ,B为
,B为 ,C为
,C为 ;
;
(2) 与CH3I反应保护酚羟基,再用酸性高锰酸钾溶液将苯环连接的甲基转化为-COOH,然后与乙醇发生酯化反应,最后在HI条件下重新得到酚羟基;
与CH3I反应保护酚羟基,再用酸性高锰酸钾溶液将苯环连接的甲基转化为-COOH,然后与乙醇发生酯化反应,最后在HI条件下重新得到酚羟基;
(3)乙基香草醛( )的同分异构体有很多种,满足下列条件的同分异构体有:①能与NaHCO3溶液反应,含有-COOH,②遇FeCl3溶液显紫色,且能与浓溴水反应,含有酚羟基,③苯环上有两个烃基,只能为2个甲基;④苯环上的官能团处于对位,即-OH与-COOH处于对位,结合②中能与浓溴水反应,说明酚羟基邻位含有H原子.
)的同分异构体有很多种,满足下列条件的同分异构体有:①能与NaHCO3溶液反应,含有-COOH,②遇FeCl3溶液显紫色,且能与浓溴水反应,含有酚羟基,③苯环上有两个烃基,只能为2个甲基;④苯环上的官能团处于对位,即-OH与-COOH处于对位,结合②中能与浓溴水反应,说明酚羟基邻位含有H原子.
解答 解:(1)乙基香草醛的同分异构体A是一种有机酸,则A中含有羧基,A被氧化后生成的B能发生银镜反应,则说明B含有醛基,A含有-CH2OH,由A与C的分子式可知,A中-OH被-Br取代生成C,A能被酸性高锰酸钾溶液氧化生成苯甲酸,则A是 ,B为
,B为 ,C为
,C为 .
.
①由A→C的反应方程式: ,属于取代反应,
,属于取代反应,
故答案为:取代反应;
②B的结构简式为 ,故答案为:
,故答案为: ;
;
③在加热条件下C与NaOH醇溶液发生反应的化学方程式: ,
,
故答案为: ;
;
(2) 与CH3I反应保护酚羟基,再用酸性高锰酸钾溶液将苯环连接的甲基转化为-COOH,然后与乙醇发生酯化反应,最后在HI条件下重新得到酚羟基,合成路线流程图为:
与CH3I反应保护酚羟基,再用酸性高锰酸钾溶液将苯环连接的甲基转化为-COOH,然后与乙醇发生酯化反应,最后在HI条件下重新得到酚羟基,合成路线流程图为: ,
,
故答案为: ;
;
(3)乙基香草醛( )的同分异构体有很多种,满足下列条件的同分异构体有:①能与NaHCO3溶液反应,含有-COOH,②遇FeCl3溶液显紫色,且能与浓溴水反应,含有酚羟基,③苯环上有两个烃基,只能为2个甲基;④苯环上的官能团处于对位,即-OH与-COOH处于对位,结合②中能与浓溴水反应,说明酚羟基邻位含有H原子,其同分异构体有:
)的同分异构体有很多种,满足下列条件的同分异构体有:①能与NaHCO3溶液反应,含有-COOH,②遇FeCl3溶液显紫色,且能与浓溴水反应,含有酚羟基,③苯环上有两个烃基,只能为2个甲基;④苯环上的官能团处于对位,即-OH与-COOH处于对位,结合②中能与浓溴水反应,说明酚羟基邻位含有H原子,其同分异构体有: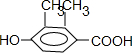 、
、
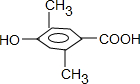 三种,其中有一种同分异构体的核磁共振氢谱中出现4组峰,吸收峰的面积之比为1:1:2:6,该同分异构体的结构简式为
三种,其中有一种同分异构体的核磁共振氢谱中出现4组峰,吸收峰的面积之比为1:1:2:6,该同分异构体的结构简式为 ,
,
故答案为:3; .
.
点评 本题考查有机物推断与合成、同分异构体书写、有机反应方程式书写等,需要学生熟练掌握官能团的性质与转化,较好的考查学生自学能力与知识迁移运用,题目难度中等.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 丙烷和丙烯 | B. | 乙烷和丙烯 | C. | 丙烯和丁炔 | D. | 丁烯和丙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2012年夏,发生在多地的暴雨共造成亿万人受灾.水是组成生命体的重要化学物质,也是一种重要的溶剂,同时也是参与化学反应的重要试剂.怎样利用水为百姓造福将是今后研究的重要课题.请回答下列问题:
2012年夏,发生在多地的暴雨共造成亿万人受灾.水是组成生命体的重要化学物质,也是一种重要的溶剂,同时也是参与化学反应的重要试剂.怎样利用水为百姓造福将是今后研究的重要课题.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将金属钠投入冷水中,钠熔为小球,说明钠与水的反应为放热反应且钠的熔点低 | |
| B. | 将铜与浓硫酸共热,产生使石蕊溶液变红的气体,说明浓硫酸具有酸性 | |
| C. | 向AgCl浊液中滴加Na2S溶液,白色沉淀变成黑色,说明AgCl的溶解平衡正向移动 | |
| D. | 向Al(OH)3沉淀中滴加NaOH溶液或盐酸,沉淀均消失,说明Al(OH)3是两性氢氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
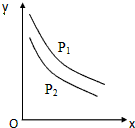 反应:L(固)+aG(气)=bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,X轴表示温度,Y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(固)+aG(气)=bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,X轴表示温度,Y轴表示平衡混合气中G的体积分数.据此可判断( )| A. | 上述反应是放热反应 | B. | 增加L平衡右移 | ||
| C. | a>b | D. | a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiH4、PH3、H2S、HCl | B. | HF、HCl、HBr、HI | ||
| C. | H2Se、H2S、HCl、HF | D. | NH3、PH3、AsH3、HF |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
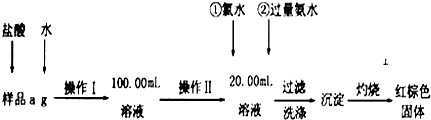
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com