
(1)甲同学取铜银合金样品14.0 g加入烧瓶中,向烧瓶中再加入13.0 mol·L-1的硝酸25.0 mL,充分反应后测得生成气体在标准状况下的体积为2.24 L,反应后烧瓶中溶液的H+浓度为1.0 mol·L-1(假设反应后溶液体积不变)。利用以上数据甲同学能得到铜的质量分数吗?如果能,请写出计算过程及结果。
(2)乙同学向烧瓶中加入物质的量为a的铜银合金样品和足量浓硝酸,充分反应后用排水法测定生成气体体积为b L(标准状况下),求铜银合金中铜的物质的量。
(1)设合金样品铜及银的物质的量分别为x和y,则14.0 g=64 g·mol-1×x+108 g·mol-1×y;由氮原子守恒可得n(HNO3)=n(NOx)+2n(Cu)+n(Ag)+n(H+),13.0 mol·L-1×0.025 L=![]() +2x+y+1.0 mol·L-1×0.025 L。解得x=0.05 mol,y=0.1 mol。铜的质量分数为:
+2x+y+1.0 mol·L-1×0.025 L。解得x=0.05 mol,y=0.1 mol。铜的质量分数为:![]() ×100%=22.9%。
×100%=22.9%。
(2)设合金样品铜及银的物质的量分别为m和n。反应后生成混合气体中的NO2能与H2O反应:3NO2+H2O====2HNO3+NO。因为①1 mol稀HNO3被金属完全还原能生成1 mol NO(转移3 mol e-);②1 mol浓HNO3被金属完全还原能生成1 mol NO2(转移1 mol e-),然后1 mol NO2又与H2O反应生成![]() mol NO,所以1 mol浓HNO3最终生成
mol NO,所以1 mol浓HNO3最终生成![]() mol NO时转移1 mol e-。综上所述,只要获得1 mol NO,HNO3都转移3 mol e-。
mol NO时转移1 mol e-。综上所述,只要获得1 mol NO,HNO3都转移3 mol e-。
HNO3—NO — 3e-
![]()
![]()
Cu — Cu2+ — 2e-
m 2m
Ag — Ag+ — e-
N n
![]()
a=m+n解得m=![]() -a,合金中铜的物质的量为
-a,合金中铜的物质的量为![]() -a。
-a。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.
有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.查看答案和解析>>
科目:高中化学 来源: 题型:
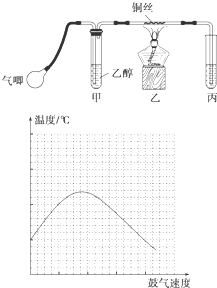 某研究性学习小组的同学利用如图所示装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去.实验时,先加热玻璃管中的铜丝,约1min后鼓入空气.
某研究性学习小组的同学利用如图所示装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去.实验时,先加热玻璃管中的铜丝,约1min后鼓入空气.查看答案和解析>>
科目:高中化学 来源: 题型:
| 读数次数 | 质量/g | |
| 第1次 | 196.30 | |
| 第2次 | 196.15 | |
| 锥形瓶十水十试样 | 第3次 | 196.05 |
| 第4次 | 196.00 | |
| 第5次 | 196.00 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验过程 | 预期现象 | 实际观察到的现象 |
| a取已切去表皮的一小块金属钠,放入盛有水的某容器中 | 立即剧烈反应 |
开始时钠块浮在水面上不反应,稍后才开始与水剧烈反应 |
| b向盛有适量水(内含2滴 酚酞的试管中加入一小段镁条 |
有气泡产生,溶液变红色 | 没有相应现象,加热后仍无明显变化 |
| c向两支盛有3mL6mol?L-1盐酸的试管中加入大小相同的镁片和铝片 | 镁、铝与盐酸反应产生气泡剧烈程度不同 | 镁与盐酸反应产生气泡速率较快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com