
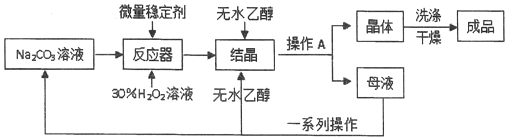

分析 I、制备过碳酸钠,是在碳酸钠溶液中加入稳定剂和双氧水,可生成过碳酸钠,在溶液中加入无水乙醇,使过碳酸钠从溶液中析出,过滤得过碳酸钠晶体,经洗涤、干燥得成品,滤液经分离得碳酸钠溶液和无水乙醇,再循环利用,
(1)Na2CO3俗名为纯碱,其水溶液中碳酸根离子水解,能使溶液呈碱性;
(2)H2O2受热容易分解,生成水和氧气,据此答题;
(3)根据过碳酸钠不稳定,受热易分解考虑;
(4)过碳酸钠在乙醇中的溶解度较小,据此答题;
(5)根据不溶于液体的固体和液体分离的方法和过滤操作用到的仪器答题;
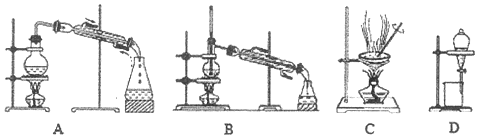
(6)母液里主要是过碳酸钠和乙醇,要使所含有的物质可以循环使用,要先将过碳酸钠分解得到碳酸钠,再进行蒸馏,可得Na2CO3溶液和95%的乙醇,将95%的乙醇变为无水乙醇,要向95%的乙醇中加入足量CaO后,再进行蒸馏,据此选择装置;
II、纯度测定:过碳酸钠在二氧化锰作催化剂的条件下能产生氧气,根据氧气的体积可计算出样品中过碳酸钠的质量,进而确定样品中过碳酸钠的质量分数,
(7)根据实验原理可知,要将过碳酸钠充分分解才能停止加水,过碳酸钠分解时有氧气产生,可以根据是否有气体产生判断过碳酸钠分解是否完全;
(8)根据装置图可知,当气体热胀冷缩时,量筒中液面会发生变化,据此判断;
(9)根据如果使用短导管造成的后果考虑;
(10)开始锥形瓶中有空气,最后锥形瓶中留有制取的气体考虑;
(11)读取量筒中液体体积时应使液体的凹液面与刻度线水平;量筒的小刻度在度部,而实验中量筒是倒置的,据此分析;
(12)根据题意,有关系式2(2Na2CO3•3H2O2)~3O2,根据量筒中收集到气体的体积可计算过碳酸钠样品中2Na2CO3•3H2O2的质量,进而确定其质量分数:
(13)根据装置图可知,当量筒中的液面高于水槽中的时,量筒内部气压小于外界大气压,使测量的气体体积偏大,会导致测得的氧气的体积偏大,据此分析.
解答 解:(1)Na2CO3俗名为纯碱,其水溶液中碳酸根离子水解,能使溶液呈碱性,所以其水溶液能使酚酞变红,
故答案为:纯碱;红;
(2)H2O2受热容易分解,生成水和氧气,反应的化学方程式为2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑;
(3)H2O2和2Na2CO3•3H2O2不稳定,受热易分解,所以生产过程中,反应及干澡均需在低温度下进行,防止其分解,
故答案为:H2O2和2Na2CO3•3H2O2受热都容易分解;
(4)过碳酸钠在乙醇中的溶解度较小,所以实验过程中用无水乙醇能降低过碳酸钠溶解度,
故答案为:无水乙醇能降低过碳酸钠溶解度;
(5)操作A为分离不溶于液体的固体和液体,所以操作A为过滤,过滤时用到的玻璃仪器是烧杯、玻璃棒和漏斗,
故答案为:过滤;漏斗;
(6)母液里主要是过碳酸钠和乙醇,要使所含有的物质可以循环使用,要先将过碳酸钠分解得到碳酸钠,再进行蒸馏,可得Na2CO3溶液和95%的乙醇,要使过碳酸钠分解,要加MnO2做催化剂,然后再过滤将二氧化锰除去,将95%的乙醇变为无水乙醇,要向95%的乙醇中加入足量CaO后,再进行蒸馏,所以要选择A装置,
故答案为:MnO2;蒸馏;A;
(7)根据实验原理可知,要将过碳酸钠充分分解才能停止加水,过碳酸钠分解时有氧气产生,可以根据是否有气体产生判断过碳酸钠分解是否完全,所以步骤④为待装置A中无气泡冒出(或无明显现象)时,停止滴加水,并关闭活塞,
故答案为:无气泡冒出(或无明显现象);
(8)根据装置图可知,当气体热胀冷缩时,量筒中液面会发生变化,所以第⑤中,已“冷却至室温”的判断依据是量筒内液面不再变化,
故答案为:量筒内液面不再变化;
(9)如果使用短导管由于温度降低后会使水沿着导管倒吸入锥形瓶内,所以量筒中长导管的作用是起缓冲作用,防止冷却时,(短导管)将量筒中的水倒吸入A中影响测量,
故答案为:防止冷却时,(短导管)将量筒中的水倒吸入A中影响测量;
(10)开始锥形瓶中有空气,最后锥形瓶中留有制取的氧气,两者体积相同,所以一开始就应当收集,故选A;
(11)读取量筒中液体体积时应使液体的凹液面与刻度线水平,所以平视读数时应沿b视线 进行,量筒的小刻度在度部,而实验中量筒是倒置的,所以图中b视线对应的读数较大,
故答案为:b;b;
(12)根据题意可知量筒中收集到气体的体积是224mL,即氧气的物质的量为0.01mol,设样品中的过碳酸钠的质量为Y则:
2(2Na2CO3•3H2O2)═4Na2CO3+6H2O+3O2↑
628 3mol
Y 0.01mol
根据:$\frac{628}{Y}=\frac{3}{0.01}$ 解得Y=2.09g,所以样品中2Na2CO3•3H2O2的质量分数为:$\frac{2.09}{2.20}$×100%=95.0%,
故答案为:95.0%;
(13)根据装置图可知,当量筒中的液面高于水槽中的时,量筒内部气压小于外界大气压,使测量的气体体积偏大,会导致测得的氧气的体积偏大,所以会使测定结果偏大,
故答案为:当量筒中的液面高于水槽中的时,量筒内部气压小于外界大气压,使测量的气体体积偏大.
点评 本题考查了过碳酸钠、碳酸钠的化学性质及有关溶液及化学方程式的计算,注重考查学生的分析能力和基本计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 使用铁触媒,使N2和H2混合气体有利于合成氨 | |
| B. | 高压比常压条件更有利于合成氨的反应 | |
| C. | 700K左右比室温更有利于合成氨的反应 | |
| D. | 合成氨时采用循环操作,可提高原料的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用红色石蕊试纸检验溶液的酸性 | |
| B. | 用苯萃取碘水中的碘单质,液体分层,上层为紫红色 | |
| C. | 蒸馏时温度计的水银球应插在液面下 | |
| D. | 食用油和水分离,四氯化碳和水分离,均可用分液漏斗,且油层从下口流出 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
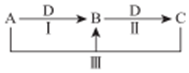 A、B、C、D 都是中学化学中常见物质,其中 A、B、C 均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
A、B、C、D 都是中学化学中常见物质,其中 A、B、C 均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某弱酸的酸式盐NaHA溶液中一定有:c(OH-)+2c(A2-)=c(H+)+c(H2A) | |
| B. | 0.2 mol•L-1 CH3COONa溶液与0.1 mol•L-1盐酸等体积混合后的酸性溶液中:>c(CH3COO-)>c(CH3COOH)>c(Cl-)>c(H+) | |
| C. | 室温下,向100ml0.5mol/L的Na2CO3溶液中加入0.05molCaO,溶液中增大$\frac{c(O{H}^{-})}{c(H{{C}_{3}}^{-})}$ | |
| D. | 0.1 mol•L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
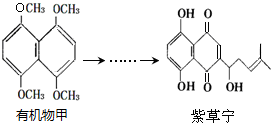
| A. | 有机物甲中共有两种化学环境下的氢 | |
| B. | 紫草宁的分子式为C16H18O5 | |
| C. | 紫草宁有8个不饱和度 | |
| D. | 在一定条件下,紫草宁可以发生氧化反应、还原反应、取代反应、加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知25℃时NH4CN水溶液显碱性,则25℃时的电离平衡常数K(NH3•H2O)>K(HCN) | |
| B. | 25℃时,Mg(OH)2固体在20mL 0.01mol•L-1氨水中的KSP比在20mL 0.01mol•L-1NH4Cl溶液中的KSP小 | |
| C. | pH试纸测得新制氯水的pH为4.5 | |
| D. | NaHCO3溶液加热蒸干灼烧,得NaHCO3固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com