
【题目】反应N2O4(g)![]() 2NO2(g)在温度为T1、T2(T2>T1)时,平衡体系中NO2的体积分数随压强变化如图所示。下列说法正确的是
2NO2(g)在温度为T1、T2(T2>T1)时,平衡体系中NO2的体积分数随压强变化如图所示。下列说法正确的是

A. 由图可知B点的平衡常数大于C点的平衡常数
B. A、C两点气体的颜色:A深,C浅
C. A、C两点气体的平均相对分子质量:A<C
D. 保持容器体积不变,再充入N2O2气体,平衡逆向移动
科目:高中化学 来源: 题型:
【题目】保持温度不变,用惰性电极电解足量饱和的Na2CO3溶液,一段时间后下列叙述正确的是( )
A.Na2CO3溶液的碱性增强
B.阳极反应:CO32--2e-+H2O = CO2↑+2OH-
C.溶液中CO32-+H2O ![]() HCO3-+OH-平衡不移动
HCO3-+OH-平衡不移动
D.向溶液中加入一定量HCOOH的能复原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如图所示的微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是

A. 断开K2,闭合K1时,总反应的离子方程式为:2H+ + 2Cl-![]() Cl2↑+H2↑
Cl2↑+H2↑
B. 断开K2,闭合K1时,石墨电极附近溶液变红
C. 断开K1,闭合K2时,铜电极上的电极反应为: Cl2+2e-=2Cl-
D. 断开K1,闭合K2时,石墨电极作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知a、b、c、d、e、f都是周期表中前四周期的元素,它们的原子序数依次增大。其中a、c原子的L层有2个未成对电子,d与e同主族,d的二价阳离子与c的阴离子具有相同的电子层结构,f3+离子M层3d轨道电子为半充满状态。请根据以上信息,回答下列问题(答题时,用所对应的元素符号表示):
(1)画出f3+离子的价层电子排布图__________,bH3分子中b原子的价层电子对构型为__________。
(2)写出一种与ab-互为等电子体的分子的化学式_________,ab-中a原子的杂化方式为_______。
(3)f和m(质子数为25) 两元素的部分电离能数据列于下表:
元素 | m | f | |
电能(kJ·mol-1) | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态m2+再失去一个电子比气态f2+再失去一个电子难,原因是____________。
(4)已知e的碳酸正盐热分解温度比d的高,其原因是___________________。
(5)已知CaF2晶体常用于助熔剂,其晶胞结构如图所示。
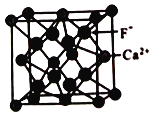
设阿伏加德罗常数的值为NA ,F原子和Ca原子之间的距离为apm,在晶胞体对角线的1/4、3/4两点分别有个F-,则Ca2+的配位数是_______,晶体的密度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.萃取操作可在普通漏斗中完成
B.浓烧碱液沾到皮肤上应立即用稀盐酸冲洗
C.用酒精灯加热试管内液体时一定要先给试管预热再集中加热液体部位
D.用托盘天平称出25.20g氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g)达到平衡。缩小容器容积,对反应产生影响的叙述不正确的是
2SO3(g)达到平衡。缩小容器容积,对反应产生影响的叙述不正确的是
A. 使SO3的浓度增大 B. 使平衡向正反应方向移动
C. 使平衡常数K增大 D. 使正反应速率大于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的一些说法中,不正确的是( )
A.合金的性质与其成分金属的性质不完全相同
B.工业上金属Mg、Al都是电解熔融氯化物制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属单质
D.越活泼的金属越难冶炼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如图:
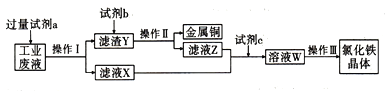
已知: FeCl3在加热情况下与水反应生成Fe(OH)3。
回答下列问题:
(1)试剂a是________,过量的原因是__________。操作I用到的玻璃仪器是__________。
(2)滤液X、Z中都有同一种溶质,请设计实验验证该溶质的离子:___________
(3)向沸水中逐滴滴加1mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是____nm,检验溶液中Fe3+存在的试剂是_________(填物质名称),证明Fe存在的现象是__________。电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶被与铜反应的离子方程式:______。
(4)若要验证溶液中不含Fe3+而只含有Fe2+,正确的实验操作方法及现象是___________。
(5)硫铁矿烧渣的主要成分为Fe2O3、FeO、SiO2等,欲测定硫铁矿烧清中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤被中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg。计算该样品中Fe元素的质量分数为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com