
【题目】完全燃烧一定质量的无水乙醇,放出的热量为Q,已知为了完全吸收生成的二氧化碳,消耗50mL 8mol/L的氢氧化钠溶液,则无水乙醇的燃烧放出的热量不可能是( )
A. 10Q B. 5Q~10Q C. 大于10Q或小于5Q D. 小于8Q
【答案】C
【解析】n(NaOH)=8mol/L![]() 0.05L=0.4mol;NaOH完全吸收CO2可能生成Na2CO3、NaHCO3、Na2CO3和NaHCO3的混合物;若只生成Na2CO3,反应的化学方程式为CO2+2NaOH=Na2CO3+H2O,n(CO2)=
0.05L=0.4mol;NaOH完全吸收CO2可能生成Na2CO3、NaHCO3、Na2CO3和NaHCO3的混合物;若只生成Na2CO3,反应的化学方程式为CO2+2NaOH=Na2CO3+H2O,n(CO2)=![]() n(NaOH)=0.2mol;若只生成NaHCO3,反应的化学方程式为CO2+NaOH=NaHCO3,n(CO2)=n(NaOH)=0.4mol;乙醇完全燃烧生成的CO2物质的量:0.2mol
n(NaOH)=0.2mol;若只生成NaHCO3,反应的化学方程式为CO2+NaOH=NaHCO3,n(CO2)=n(NaOH)=0.4mol;乙醇完全燃烧生成的CO2物质的量:0.2mol![]() n(CO2)
n(CO2)![]() 0.4mol,则乙醇物质的量:0.1mol
0.4mol,则乙醇物质的量:0.1mol![]() n(CH3CH2OH)
n(CH3CH2OH)![]() 0.2mol;1mol无水乙醇燃烧放出的热量大于等于5Q(
0.2mol;1mol无水乙醇燃烧放出的热量大于等于5Q(![]() =5Q),小于等于10Q(
=5Q),小于等于10Q(![]() =10Q);不可能的是大于10Q或小于5Q,答案选C。
=10Q);不可能的是大于10Q或小于5Q,答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4) mol/L | 实验 温度/℃ | 金属消失 的时间/s |
1 | 0.10 | 丝 | 0.7 | 20 | 250 |
2 | 0.10 | 丝 | 1.0 | 20 | 200 |
3 | 0.10 | 粉末 | 1.0 | 20 | 125 |
4 | 0.10 | 粉末 | 1.0 | 30 | 50 |
分析上述数据,回答下列问题:
(1)①实验1、2可得出的结论是,硫酸浓度越_____,反应速率越慢;
②实验3、4可得出的结论是温度越_____,反应速率越快.
(2)①用铁粉和稀硫酸反应制取H2,实验过程中绘制出生成H2的体积(V)与时间(t)的关系如图所示. 试分析判断OE段、EF段、FG段、GH段反应速率(分别用v (OE)、v (EF)、v (FG)、v (GH)表示)最快时段是______.
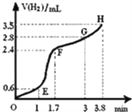
A.v (OE) B.v (EF)C.v (FG) D.v (GH)
②1min内反应较慢的原因是:_________;一段时间后反应明显加快的原因是_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,氯化亚硝酰(NOCl)足一种红黄色气体,其熔点- 64.5℃,沸点-5.5℃,可被水分解,其一种制备原理为Cl2+2NO =2NOC1。实验装置如下图所示,回答下列问题:

(1)实验前须排尽装置I、Ⅱ、Ⅲ中的空气,其原因是__________________________。
(2)NO是用铜与稀硝酸反应制得,其离子方程式为__________________________。
(3)图中各装置连接顺序为a→________________(按气流自左向右方向,用小写字母表示)。
(4)装置I、Ⅱ的作用是观察气泡调节气体的流速和________________________________。
(5)装置V是为了吸收尾气,防止污染环境,其中吸收NOC1时反应的化学方程式为____________(非氧化还原反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬酸铁铵[(NH4)3Fe( C6 H5O7)2,摩尔质量488 g/mol] 是一种重要的食品添加剂。一种制备柠檬酸铁铵的实验步骤如下:

步骤1.在右图三颈烧瓶中加入16.7 g FeSO4·7H2O、40 ml.蒸馏水,3mL硫酸和1 g NaClO3,强力搅拌;
步骤2.升温至80℃,再补加l g NaClO3;
步骤3.向反应器中加入NaOH溶液,温度控制在80~90℃,剧烈搅拌;
步骤4.过滤,洗涤,沥干,得活性Fe(OH)3;
步骤5.将Fe(OH)3和一定量的水加入三颈烧瓶中,控制95℃以上,加入计算量的柠檬酸溶液,搅拌,并保温1h;
步骤6.冷却到50℃,搅拌下加入氨水40 mL,静置、浓缩至膏状,80℃干燥得柠檬酸铁铵24.9 g。
回答下列问题:
(1)步骤1发生反应的离子方程式为_____________________________。
(2)步骤2再补加NaClO3的目的是_____________________________。
(3)步骤3确定Fe3+已沉淀完全的方法是_____________________________。
(4)步骤4过滤时,所需硅酸盐质仪器除烧杯外,还需要_____________________________;证明Fe(OH)3已被洗涤干净的方法为__________________________。
(5)柠檬酸铁铵的产率为_________(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组模拟“人工树叶”电化学装置如图所示,该装置能将H2O和CO2转化为糖类(C6H12O6)和O2,X、Y是特殊催化剂型电极,已知:装置的电流效率等于生成产品所需的电子数与电路中通过总电子数之比。下列说法错误的是( )

A. 该装置中Y电极发生氧化反应
B. X电极的电极反应式为 6CO2+24H++24e-=== C6H12O6+6H2O
C. 理论上,每生成22.4 L(标准状况下)O2,必有4 mol H+由X极区向Y极区迁移
D. 当电路中通过3 mol e时,生成18 g C6H12O6,则该装置的电流效率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式CO32﹣+2H+═H2O+CO2↑中CO32﹣的代表的物质可以是( )
A.CaCO3
B.NaHCO3
C.Na2CO3
D.BaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关仪器的使用方法或实验操作正确的是( )
A.用碱式滴定管量取13.60mL酸性高锰酸钾溶液
B.测定硫酸铜晶体结晶水含量时,加热后的坩埚须在干燥器中冷却,再称量
C.蒸馏时,应使温度计水银球置于蒸馏液体中
D.过滤时,先将滤纸湿润,然后再将滤纸放入漏斗中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是( )

A. K1闭合,铁棒上发生的反应为2H++2e-→H2↑
B. K1闭合,石墨棒周围溶液pH逐渐升高
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com