
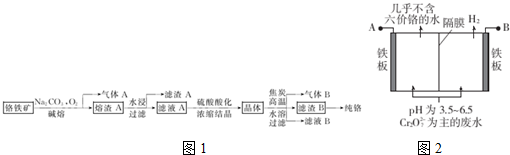
分析 铬铁矿组成为Fe0•Cr203或FeCr2O4,在碳酸钠碱熔条件下与氧气发生氧化还原反应,亚铁离子被氧化成氧化铁,同时生成Na2CrO4和CO2,所以气体A为CO2,熔渣A为Fe203、Na2CrO4,熔渣A溶于水后过滤得滤渣A为Fe203,滤液A为Na2CrO4溶液,Na2CrO4溶液经硫酸酸化,再浓缩结晶得晶体Na2Cr2O7,与焦碳在高温下氧化还原反应生成CO、氧化铬和碳酸钠,所以气体B为CO,溶解再过滤可得滤渣B为Cr203,滤液B为Na2CO3溶液,生成的碳酸钠可循环利用,含铬废水常采用电解法处理,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,根据图可知,与B相连的铁板电极产生氢气,所以该电极为阴极,该电极附近溶液酸性减弱,则与A相连的铁板为阳极,在阳极上铁放电产生亚铁离子,亚铁离子再还原Cr2O72-离子,根据电子得失守恒可判断被还原的Cr2O72-的物质的量,据此答题;
解答 解:铬铁矿组成为Fe0•Cr203或FeCr2O4,在碳酸钠碱熔条件下与氧气发生氧化还原反应,亚铁离子被氧化成氧化铁,同时生成Na2CrO4和CO2,所以气体A为CO2,熔渣A为Fe203、Na2CrO4,熔渣A溶于水后过滤得滤渣A为Fe203,滤液A为Na2CrO4溶液,Na2CrO4溶液经硫酸酸化,再浓缩结晶得晶体Na2Cr2O7,与焦碳在高温下氧化还原反应生成CO、氧化铬和碳酸钠,所以气体B为CO,溶解再过滤可得滤渣B为Cr203,滤液B为Na2CO3溶液,生成的碳酸钠可循环利用,含铬废水常采用电解法处理,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,根据图可知,与B相连的铁板电极产生氢气,所以该电极为阴极,该电极附近溶液酸性减弱,则与A相连的铁板为阳极,在阳极上铁放电产生亚铁离子,亚铁离子再还原Cr2O72-离子,根据电子得失守恒可判断被还原的Cr2O72-的物质的量,
(1)铬铁矿和焦炭在电炉中发生氧化还原反应,可以生成铬、铁和一氧化碳,反应的化学方程式为FeCr2O4+4C$\frac{\underline{\;高温\;}}{\;}$Fe+2Cr+4CO↑,
故答案为:FeCr2O4+4C$\frac{\underline{\;高温\;}}{\;}$Fe+2Cr+4CO↑;
(2)根据影响反应速率的因素可知,为加快铬铁矿的碱熔速率,可采取的措施有将铬铁矿粉碎、升高反应温度、加速、适当增大氧气浓度等,滤渣A为氧化铁,其俗称为铁红,根据上面的分析可知,铬铁矿氧化碱熔的化学方程式为4FeCr2O4+8Na2CO3+7O2$\frac{\underline{\;高温\;}}{\;}$8Na2CrO4+8CO2+2Fe203,
故答案为:将铬铁矿粉碎、升高反应温度、加速、适当增大氧气浓度等;铁红;4FeCr2O4+8Na2CO3+7O2$\frac{\underline{\;高温\;}}{\;}$8Na2CrO4+8CO2+2Fe203;
(3)根据上面的分析可知,晶体的主要成分的化学式为Na2Cr2O7,
故答案为:Na2Cr2O7;
(4)根据上面的分析可知,气体B为 CO,根据流程图可知,整个过程中可循环利用的一种物质是 Na2CO3,
故答案为:CO;Na2CO3;
(5)氧化铬通过热还原法获得铬,可以通过铝热反应得到,则此处适合用作还原剂的物质为金属铝,
故答案为:铝;
(6)a.根据图可知,与B相连的铁板电极产生氢气,所以该电极为阴极,该电极附近溶液酸性减弱,则与A相连的铁板为阳极,所以A为电源正极,故a正确;
b.在阳极上铁放电产生亚铁离子,亚铁离子再还原Cr2O72-离子,所以阳极区溶液中发生的氧化还原反应为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,故b正确;
c.阴极上氢离子放电产生氢气,所以阴极区附近溶液pH升高,故c错误;
d.当收集到H2 13.44L(标准状况)即0.6mol时,根据电子守恒可知,能产亚铁离子也是0.6mol,根据反应Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O可知,有0.1mol Cr2O72-被还原,故d正确;
故选abd.
点评 本题考查了物质制备流程和方案的分析判断,物质性质的应用,题干信息的分析理解,操作步骤的注意问题和基本操作方法是解题关键,题目难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=7的溶液 | |
| B. | 氨水和硫酸铵的混合液中c(NH4+)=2c(SO42-) | |
| C. | c(H+)=10-7 mol•L-1的溶液 | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-14的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1L2mol•L-1的(NH4)2S溶液中含有的S2-数目为0.2NA | |
| B. | 7.8g苯中含有C=C键数目为0.3NA | |
| C. | 常温常压下,5.6g乙烯和环丙烷的混合气体中含有的碳原子数为0.4NA | |
| D. | 用惰性电极电解1L浓度均为2mol•L-1的AgNO3与Cu(NO3)2的混合溶液,当有0.2NA个电子转移时,理论上阴极析出6.4g金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水应保存在棕色瓶中,久置的氯水,pH值减小 | |
| B. | 新制饱和氯水中存在4个平衡 | |
| C. | 在一定浓度的氯水中加小苏打,$\frac{c(HClO)}{c(C{l}^{-})}$不变 | |
| D. | 饱和氯水与石灰石的反应是制取较浓HClO溶液的重要方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
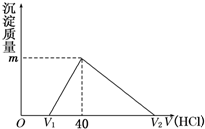 将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如下图所示,则下列选项正确的是( )
将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如下图所示,则下列选项正确的是( )| A. | 图中m值为1.56 g | B. | 标准状况下产生氢气896 mL | ||
| C. | 图中V2为60 mL | D. | 原合金质量为0.92 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50 s | B. | 30 s | C. | 5 s | D. | 1 s |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com