
【题目】重铬酸钾![]() 是高中化学常见的氧化剂,工业上以铬铁矿为原料用碱溶氧化法制备.铬铁矿中通常含有
是高中化学常见的氧化剂,工业上以铬铁矿为原料用碱溶氧化法制备.铬铁矿中通常含有![]() 、FeO、
、FeO、![]() 、
、![]() 等.
等.
已知:①![]() 遇水强烈水解.
遇水强烈水解.
②![]() 黄色
黄色![]() 橙色
橙色![]()
请回答下列问题:
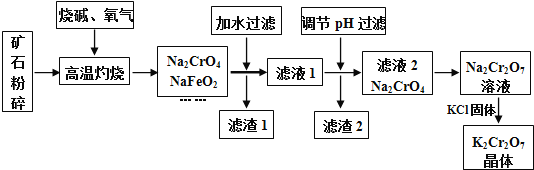
(1)将矿石粉碎的目的是 ______ ;高温灼烧时![]() 发生反应的化学方程式为 ______ .
发生反应的化学方程式为 ______ .
(2)滤渣1中有红褐色物质,写出生成该物质反应的离子方程式 ______ ![]() 滤渣2的主要成分是
滤渣2的主要成分是![]() 和 ______ .
和 ______ .
(3)用简要的文字说明![]() 溶液中加入KCl固体,降温析出
溶液中加入KCl固体,降温析出![]() 的原因 ______ .
的原因 ______ .
(4)![]() 时,对反应
时,对反应![]() 黄色
黄色![]() 橙色
橙色![]() ,取
,取![]() 溶液进行实验,测得部分实验数据如下:
溶液进行实验,测得部分实验数据如下:
时间 | 0 |
|
|
|
|
|
|
|
|
| |
| 0 |
|
|
|
①反应达到平衡时,溶液的![]() ,该反应平衡常数K为 ______ .
,该反应平衡常数K为 ______ .
②下列有关说法正确的 ______ .
![]() 加少量
加少量![]() 固体,可使溶液的橙色加深
固体,可使溶液的橙色加深
![]() 时
时![]()
![]() 溶液中
溶液中![]() :
:![]() :1时该反应已达平衡状态
:1时该反应已达平衡状态
![]() 反应达到平衡时
反应达到平衡时![]() 的转化率为
的转化率为![]()
【答案】增大反应物的表面积,加快反应速率 
![]()
![]()
![]() 的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小
的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小 ![]() bd
bd
【解析】
铁矿中通常含有![]() 、FeO、
、FeO、![]() 、
、![]() 等,将铬铁矿和烧碱、氧气混合焙烧得到
等,将铬铁矿和烧碱、氧气混合焙烧得到![]() 、
、![]() ,而
,而![]() 与NaOH发生反应生成
与NaOH发生反应生成![]() ,
,![]() 与NaOH发生反应,生成
与NaOH发生反应,生成![]() ,故还含有
,故还含有![]() 、
、![]() ,由于
,由于![]() 会发生强烈水解,滤渣1中有红褐色物质,可推知
会发生强烈水解,滤渣1中有红褐色物质,可推知![]() 水解生成氢氧化钠与氢氧化铁,过滤分离,滤液1中主要是
水解生成氢氧化钠与氢氧化铁,过滤分离,滤液1中主要是![]() 、
、![]() 、
、![]() 、NaOH,滤渣1为
、NaOH,滤渣1为![]() ;调节溶液pH,使
;调节溶液pH,使![]() 、
、![]() 反应转化为
反应转化为![]() 、
、![]() 沉淀,过滤除去,滤液2主要是
沉淀,过滤除去,滤液2主要是![]() ,加入硫酸酸化,溶质变为
,加入硫酸酸化,溶质变为![]() ,然后加入KCl固体,利用溶解度不同或者受温度影响不同,结晶得到
,然后加入KCl固体,利用溶解度不同或者受温度影响不同,结晶得到![]() 晶体,采用过滤方法得到
晶体,采用过滤方法得到![]() 晶体,
晶体,
![]() 增大反应物的表面积,加快反应速率;发生氧化还原反应,
增大反应物的表面积,加快反应速率;发生氧化还原反应,![]() 与
与![]() 、NaOH反应生成
、NaOH反应生成![]() 与水;
与水;
![]() 会发生强烈水解生成氢氧化钠与氢氧化铁;滤渣2的主要成分是氢氧化铝与硅酸;
会发生强烈水解生成氢氧化钠与氢氧化铁;滤渣2的主要成分是氢氧化铝与硅酸;
![]() 的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小;
的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小;
![]() 时
时![]() ,与
,与![]() 时的浓度相等,故
时的浓度相等,故![]() 时处于平衡状态,再根据
时处于平衡状态,再根据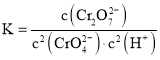 计算;
计算;
![]() 加少量
加少量![]() 固体,消耗氢离子,平衡逆向移动;
固体,消耗氢离子,平衡逆向移动;
![]() 时处于平衡状态,不同物质表示的正逆速率之比等于其化学计量数之比;
时处于平衡状态,不同物质表示的正逆速率之比等于其化学计量数之比;
![]() 平衡时各组分的浓度不一定等于化学计量数之比,与转化率等有关;
平衡时各组分的浓度不一定等于化学计量数之比,与转化率等有关;
![]() 转化率
转化率![]() 。
。
铁矿中通常含有![]() 、FeO、
、FeO、![]() 、
、![]() 等,将铬铁矿和烧碱、氧气混合焙烧得到
等,将铬铁矿和烧碱、氧气混合焙烧得到![]() 、
、![]() ,而
,而![]() 与NaOH发生反应生成
与NaOH发生反应生成![]() ,
,![]() 与NaOH发生反应,生成
与NaOH发生反应,生成![]() ,故还含有
,故还含有![]() 、
、![]() ,由于
,由于![]() 会发生强烈水解,滤渣1中有红褐色物质,可推知
会发生强烈水解,滤渣1中有红褐色物质,可推知![]() 水解生成氢氧化钠与氢氧化铁,过滤分离,滤液1中主要是
水解生成氢氧化钠与氢氧化铁,过滤分离,滤液1中主要是![]() 、
、![]() 、
、![]() 、NaOH,滤渣1为
、NaOH,滤渣1为![]() ;调节溶液pH,使
;调节溶液pH,使![]() 、
、![]() 反应转化为
反应转化为![]() 、
、![]() 沉淀,过滤除去,滤液2主要是
沉淀,过滤除去,滤液2主要是![]() ,加入硫酸酸化,溶质变为
,加入硫酸酸化,溶质变为![]() ,然后加入KCl固体,利用溶解度不同或者受温度影响不同,结晶得到
,然后加入KCl固体,利用溶解度不同或者受温度影响不同,结晶得到![]() 晶体,采用过滤方法得到
晶体,采用过滤方法得到![]() 晶体,
晶体,
![]() 将矿石粉碎的目的是:增大反应物的表面积,加快反应速率;发生氧化还原反应,
将矿石粉碎的目的是:增大反应物的表面积,加快反应速率;发生氧化还原反应,![]() 与
与![]() 、NaOH反应生成
、NaOH反应生成![]() 与水,反应方程式为:
与水,反应方程式为: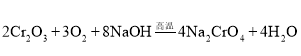 ,
,
故答案为:增大反应物的表面积,加快反应速率;![]() ;
;
![]() 会发生强烈水解生成氢氧化钠与氢氧化铁,反应离子方程式为:
会发生强烈水解生成氢氧化钠与氢氧化铁,反应离子方程式为:![]() ;滤渣2的主要成分是
;滤渣2的主要成分是![]() 和
和![]() ,
,
故答案为:![]() ;
;![]() ;
;
![]() 溶液中加入KCl固体,降温析出
溶液中加入KCl固体,降温析出![]() 的原因:
的原因:![]() 的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,
的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,
故答案为:![]() 的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小;
的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小;
![]() 时
时![]() ,与
,与![]() 时的浓度相等,故
时的浓度相等,故![]() 时处于平衡状态,反应达到平衡时,溶液的
时处于平衡状态,反应达到平衡时,溶液的![]() ,该反应平衡常数
,该反应平衡常数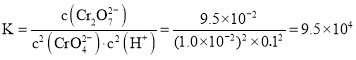 ,
,
故答案为:![]() ;
;
![]() 加少量
加少量![]() 固体,消耗氢离子,平衡逆向移动,溶液的橙色变浅,黄色加深,故a错误;
固体,消耗氢离子,平衡逆向移动,溶液的橙色变浅,黄色加深,故a错误;
![]() 时处于平衡状态,
时处于平衡状态,![]() 说明同种离子的生成熟练与消耗熟练相等,故b正确;
说明同种离子的生成熟练与消耗熟练相等,故b正确;
![]() 平衡时各组分的浓度不一定等于化学计量数之比,与转化率等有关,故c错误;
平衡时各组分的浓度不一定等于化学计量数之比,与转化率等有关,故c错误;
![]() 反应达到平衡时
反应达到平衡时![]() 的转化率为:
的转化率为:![]() ,故d正确;
,故d正确;
故答案为:bd。


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】可逆反应mA(s)+nB(g)![]() eC(g)+fD(气)反应过程中,当其他条件不变时,C的体积分数在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。下列叙述正确的是( )
eC(g)+fD(气)反应过程中,当其他条件不变时,C的体积分数在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。下列叙述正确的是( )

A.达到平衡后,若使用催化剂,C的体积分数将增大
B.当平衡后,若温度升高,化学平衡向逆反应方向移动
C.化学方程式中,n>e+f
D.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)=CO2(g) △H1<0①
途径II:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) △H2>0②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) △H3<0③
2H2(g)+O2(g)=2H2O(g) △H4<0④
请回答下列问题:
(1)途径I放出的热量_____________( 填“大于”“等于”或“小于”) 途径II放出的热量。
(2)△H1、△H2、△H3、△H4的数学关系式是_______________。
(3)12g 炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35kJ热量。其热化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol/LCH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中c(CH3COO-)/c(CH3COOH)·c(OH-)增大
C. 向盐酸中加入氨水至中性,溶液中c(NH4+)/c(Cl-)>1
D. 向AgCl、AgBr的饱和溶液中加入少量硝酸银,溶液中c(Cl-)/c(Br-)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V 1 mL 0.1mol·L-1的Fe2(SO4)3溶液与2mL 0.1mol·L-1KI溶液混合,待充分反应后,下列方法可证明该反应具有一定限度的是( )
A.若V1<1,加入淀粉B.若V1≤1,加入KSCN溶液
C.若V1≥1,加入AgNO3溶液D.加入Ba(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院某课题组将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池(如图所示),该电池可将可乐(pH=2.5)中的葡萄糖作为燃料获得能量。下列说法中正确的是( )
A. a极为正极
B. 随着反应不断进行,负极区的pH不断增大
C. b极电极反应式为MnO2+2H2O+2e-=Mn2++4OH-
D. 消耗0.01mol葡萄糖,电路中转移0.02mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下图为实验室制备、收集少量HCl的装置。

① 制备HCl所用药品为浓硫酸和浓盐酸,则甲的最佳装置应选用下图中的 。
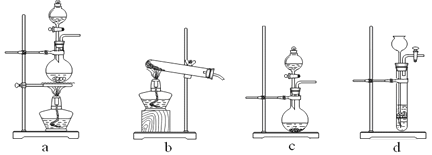
② 请解释能用浓硫酸和浓盐酸制备HCl气体的原因 。
③ 装置丙用来吸收过量的HCl气体,为防止倒吸,则烧杯中应该装入水和 。
(2)以下为苯的取代反应的探究实验。
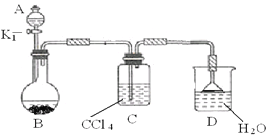
①按上图所示的装置图连接好各仪器。
②检验装置的气密性。
③在A中加入适量的苯和液溴的混合液体,在B中加入少量铁粉,塞上橡皮塞,打开K1,开始进行反应,放入适量混合液后,关闭K1。
写出B中发生反应的化学方程式 。装置C的作用是 。
④反应结束后,用试管取少量D中的溶液,加入
(描述试剂和现象),则证明B中的取代反应已经发生。
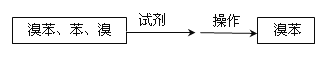
⑤把B中的固液混合物体过滤,分离出液体混合物,按下图方案精制含有苯和溴的溴苯。其中试剂为 ,操作名称为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。
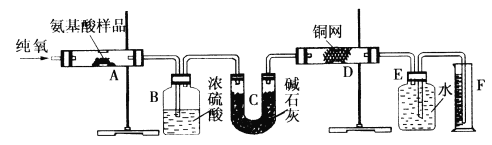
回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100g碳燃烧所得气体中,CO占![]() ,CO2占
,CO2占![]() 体积,且C(s)+
体积,且C(s)+![]() O2(g)===CO(g);ΔH(298K)=-110.35kJ·mol-1,CO(g)+
O2(g)===CO(g);ΔH(298K)=-110.35kJ·mol-1,CO(g)+![]() O2(g)===CO2(g);ΔH(298K)=-282.57kJ·mol-1。与这些碳完全燃烧相比较,损失的热量是( )
O2(g)===CO2(g);ΔH(298K)=-282.57kJ·mol-1。与这些碳完全燃烧相比较,损失的热量是( )
A.392.92kJ B.2489.44kJ
C.784.92kJ D.3274.3kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com