
| A. | AgOH溶于氨水:AgOH+2NH3•H2O=[Ag(NH3)2]++OHˉ+2H2O | |
| B. | Na2C2O4水解:C2O42-+2H2O=H2C2O4+2OH- | |
| C. | 向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| D. | 向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-=2Mn2++5SO42-+2H2O |
分析 A.AgOH与NH3•H2O反应生成银氨络离子;
B.多元弱酸根分步水解;
C.NaAlO2溶液中通入过量的CO2生成碳酸氢根离子;
D.酸性KMnO4溶液中通入SO2,反应物不可能有氢氧根离子.
解答 解:A.AgOH与NH3•H2O反应生成银氨络离子,离子方程式为:AgOH+2NH3•H2O=[Ag(NH3)2]++OHˉ+2H2O,故A正确;
B.多元弱酸根分步水解,则Na2C2O4水解:C2O42-+H2O=HC2O4-+OH-,故B错误;
C.NaAlO2溶液中通入过量的CO2生成碳酸氢根离子,其离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故C错误;
D.酸性KMnO4溶液中通入SO2,反应物中不可能有氢氧根离子,其离子方程式为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,故D错误.
故选A.
点评 本题考查了离子方程式书写,注意反应物用量对反应的影响是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 | |
| B. | NH4Cl、CH3COONa、NaHCO3、NaHSO3溶于水,对水的电离都有促进作用 | |
| C. | 浓度均为0.10mol•L-1 NH4Cl和NH4HSO4溶液,c(NH4+)前者大于后者 | |
| D. | 可用Na2CO3溶液处理水垢中的CaSO4,转化为易于除去的CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 剩余固体的铁、铜混合物 | |
| B. | 反应后溶液中n(Fe3+)=0.10mol | |
| C. | 原固体混合物中铜的质量是9.6g | |
| D. | 反应后溶液中n(Fe2+)+n(Cu2+)=0.64mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 二氧化硫不可用作食品防腐剂 | |
| B. | 裂化汽油与植物油使溴水褪色的原理相同 | |
| C. | 废旧电池中含有重金属离子,故应集中回收,填埋处理 | |
| D. | 酸雨就是pH<7的雨水,主要是由大气中的SO2、NO2等造成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S | B. | O2 | C. | H2S、SO2 | D. | SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气与氧气点燃生成水 | |
| B. | 硝酸银溶液中加入氯化钠溶液生成白色沉淀 | |
| C. | CuO与稀盐酸反应 | |
| D. | 二氧化碳使澄清石灰水变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y、Z、W形成的简单离子具有相同电子层结构,其离子半径依次增大 | |
| B. | X、Z、R三种元素构成的化合物中只含离子键 | |
| C. | 元素Z、R氧化物对应的水化物之间相互反应,生成的盐溶液只能呈中性 | |
| D. | 元素Y气态氢化物的稳定性强于元素R |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
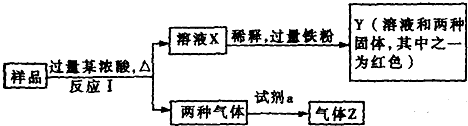
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com